文章来自~《天然产物研究与开发》2022年第2期
作者:王维刚1,2,3,阳志强2,3,4,李晓琳2,3,李茂星1,2,3,4*
1甘肃中医药大学药学院,兰州730000;2联勤保障部队第九四〇医院临床药学科;3甘肃省高原药学行业技术中心,兰州730050;4西北民族大学化工学院,兰州730030
摘要:氧气是生命活动必不可少的物质基础,由高原低压低氧及呼吸系统疾病、心血管疾病等内外界因素引起的缺氧可导致线粒体损伤,能量代谢紊乱,氧化应激,炎症爆发等一系列反应,进而损伤机体。研发安全、有效的治疗药物显得尤为重要。近年来大量研究表明,中药在抗缺氧方面有巨大的潜力。本文归纳总结了抗缺氧中药单体化合物、中药提取物及中药复方的研究进展,为抗缺氧中药的深入研究和开发提供思路,为其临床应用提供参考。
关键词:抗缺氧;缺氧损伤;单体化合物;中药提取物;中药复方
氧气是生命活动重要的组成部分,氧气供应并扩散到组织中对于生存是必不可少的,对于氧气这样一个生命活动所必需的基本物质,细胞进化出了复杂的调控机制[1]。然而,因环境问题(如高海拔地区)或自身原因(患有呼吸系统疾病等)等,缺氧情况仍然会在不同人群中出现,从而影响各项身体机能,诱导疾病的发生及加重病情的恶化。
临床上常用的抗缺氧药物一般是尼莫地平、地塞米松等西药,对缺氧症状有一定的缓解作用,但其副作用较大,应用受到很大限制。而中药在抗缺氧方面有着独特的疗效,且毒副作用少,应用广泛,可通过提高机体急性缺氧耐力,提高动脉血氧分压及血氧饱和度,保护缺氧状态下神经系统、心血管系统等免受损伤,调控缺氧状态下机体能量代谢、提高机体抗缺氧能力,抑制缺氧诱导的细胞凋亡等方面,经多层次、多靶点预防对抗缺氧损伤,具有广阔的开发应用前景。
1缺氧致各类机体损伤
人体各个器官都需要氧气,各个器官对氧气需求量各不相同。当供氧量低或者利用率减少的时候,机体便会因缺氧而产生过度的氧化应激,引发炎症反应、细胞凋亡及能量代谢紊乱等,从而导致各组织器官损伤,产生高原脑水肿、高原肺水肿、癌症及高血压等疾病[2]。
1.1脑损伤
缺氧首先会影响大脑,由于大脑本身没有葡萄糖和氧气的储备,它完全依靠血液循环来提供营养,因此大脑对局部缺血和缺氧的耐受性极差。缺氧可引起痉挛和增加血管的通透性,导致脑组织水肿,软化甚至坏死。人体可能会出现诸如注意力不集中、记忆力减退、思维缓慢、头昏眼花、嗜睡、耳鸣、焦虑和失眠等症状[3]。
1.2心肌损伤
心肌对缺氧也十分敏感,严重的心肌缺氧会引发心律不齐、心室颤动以致心脏骤停;严重或长期缺氧时,会导致心肌细胞酸碱值下降、心肌衰竭、心肌收缩力减弱、血压下降,最后导致血液循环衰竭[2]。
1.3肺损伤
缺氧还可以间接刺激呼吸中枢,引起通气增加,低氧患者会增加呼吸频率。缺氧时会引起肺小静脉血管收缩,阻力增加,导致肺动脉高压,同时肺毛细血管通透性增高,进而引发肺水肿,出现喘憋、呼吸困难等现象。肺动脉高压会使右心室射血阻力增加,并由于持续超负荷会出现右心功能衰竭[4]。缺氧还可引起交感神经兴奋进而导致全身大部分血管收缩,但是,由于脑血管和冠状动脉受体不同反而可能因缺氧扩张,使机体暂时“牺牲”相对不重要的脏器以保证心、脑的供血、供氧,但若机体失代偿则会引起心、脑等重要器官缺氧,出现昏迷等症状[5]。
1.4视网膜损伤
视网膜作为神经系统的延伸,对缺氧非常敏感。低压缺氧状态下影响血-视网膜毛细血管屏障,进一步发生高原视网膜病变,主要表现为视网膜出血、视乳头水肿、棉絮斑等病变。高原缺氧环境还可增加视网膜细胞的氧化应激水平,活性氧簇(reactiveoxygenspecies,ROS)大量释放诱导线粒体发生损害,进而导致内源性抗氧化防御系统失衡[6]。
1.5胃肠黏膜损伤
高海拔缺氧条件可导致胃肠黏膜损伤,无氧代谢增加而使代谢产物堆积,进一步加重对胃肠黏膜毛细血管的损害,致使微环境失衡,有害菌过度生长并移位而引发感染[7]。严重的高原缺氧可通过PI3K/Akt/mTOR通路降低缺氧诱导因子1α(hypoxia-inducibefactor1-alpha,HIF-1α)反应,从而减弱肠黏膜屏障功能,并诱导免疫细胞和上皮细胞的炎性反应,从而生成大量炎性细胞通过级联反应将炎症损伤进一步扩大,促使胃肠道的黏膜屏障损伤[8]。此外,由缺氧引发的过度自噬和凋亡也可能是造成胃肠黏膜损伤的原因。
2中药单体化合物抗缺氧作用
2.1多酚类
芒果苷(mangiferin,1)(见图1)是中药知母的主要活性成分。可通过抑制PI3K/Akt/mTOR通路,增加脑组织中超氧化物歧化酶(superoxidedismutase,SOD)的含量及p-PI3K、p-AKT、p-mTOR的表达,抑制缺氧缺血性脑损伤大鼠的细胞凋亡及炎症反应[9]。
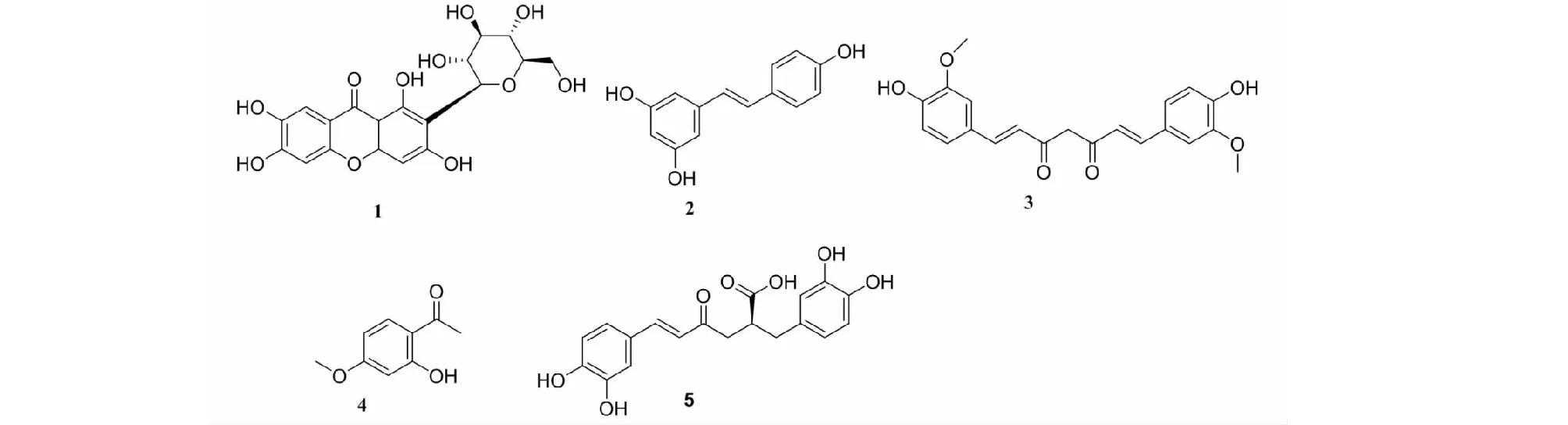
图1具有抗缺氧作用的多酚类单体化合物结构式
ect
白藜芦醇(resveratrol,2)是从虎杖、葡萄等水果中提取的多酚类天然抗毒素,具有抗炎、抗凋亡的药理学作用。它能降低新生大鼠缺血缺氧损伤脑组织的含水量,降低脑组织肿瘤坏死因子-α(tumornecrosisfactor-α,TNF-α)、白介素(interleukin,IL)-1β、细胞间黏附分子-1(intercellularcelladhesionmolecule-1,ICAM-1)含量及B淋巴细胞瘤-2基因(B-celllymphoma-2,Bcl-2)关联蛋白X(Bcl2-associatedX,Bax)、cleaved-caspase-3、核因子-κB(nuclearfactor-kappaB,NF-κB)的蛋白表达,提高Bcl-2和SIRT1蛋白表达,通过调节SIRT1/NF-κB通路抑制炎症及细胞凋亡,减轻新生大鼠缺血缺氧性脑损伤[10]。还可通过调节GFAP、HIF-1、BDNF及NF-κB的表达,发挥对高海拔缺氧诱导的视网膜损伤的保护作用[11]。
姜黄素(curcumin,3)是姜黄中的活性成分,为一种Na+/K+-ATP酶不完全促进剂,对Na+/K+-ATP酶/Src/Erk信号通路具有双向调节作用。它可降低缺氧/复氧(hypoxia-reoxygenation,H/R)导致的LLC-PK1细胞Src磷酸化和Erk磷酸化蛋白水平的升高,通过抑制由ROS过量产生而激活的Na+/K+-ATP酶/Src/Erk信号通路来保护LLC-PK1细胞免受缺氧复氧损伤[12]。
丹皮酚(paeonolum,4)是从中药牡丹根皮或徐长卿干燥根中提取的一种小分子酚类化合物,可减弱乳酸盐脱氢酶和肌酸激酶的释放,通过抑制微小RNA(miRNA)-155-5p的表达而减弱H/R导致的H9c2细胞损伤[13]。
迷迭香酸(rosmarinicacid,5)是一种广泛存在于丹参、紫苏、夏枯草等中药中的天然酚酸类化合物,具有较强的抗氧化、抗炎、抗肿瘤等活性。Chen等[14]研究发现,可上调血脑屏障连接蛋白ZO-1、Claudin-5和转运蛋白P-gpmRNA表达,激活PI3K/Akt信号通路,进而保护H/R损伤的血脑屏障功能。
2.2黄酮类
异甘草素(isoliquiritigenin,6)(见图2)是甘草中的重要活性成分,具有抗肿瘤、抗氧化、抗炎等作用,还可维持糖尿病大鼠心肌功能、代谢及心肌细胞结构正常。Yu等[15]研究发现,异甘草素可通过抑制SETD7表达而抵抗细胞凋亡及增强其抗氧化能力,从而对H/R损伤心肌细胞发挥保护作用。
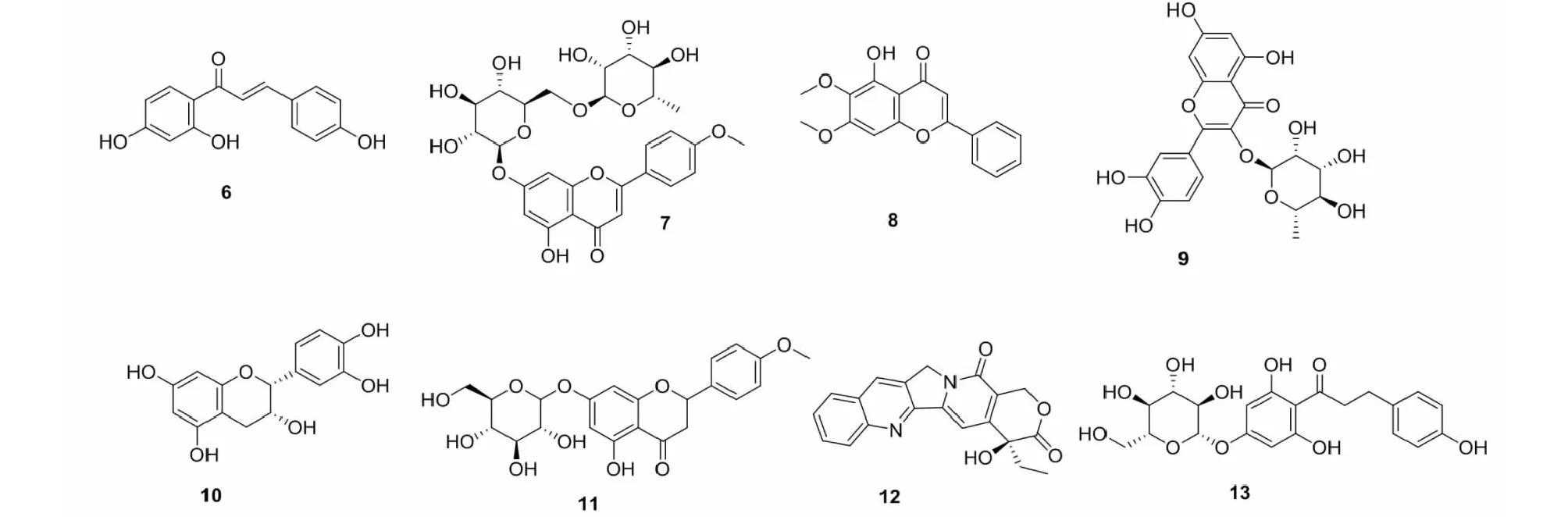
图2具有抗缺氧作用的黄酮类单体化合物结构式
ct
蒙花苷(buddleoside,7)是新疆特有植物芳香新塔花总黄酮抗心肌缺血中主要的有效成分之一,具有抗衰老、抗缺氧及抗疲劳的作用。能抑制H/R损伤心肌细胞Bax蛋白表达并升高Bcl-2蛋白表达,抑制心肌细胞的凋亡,上调p-Akt的表达,通过调节PI3K/Akt信号通路减轻H/R对H9c2心肌细胞的损伤[16]。
荠苎黄酮(moslosooflavone,8)是从苏州荠苎(MoslasoochowensisMatsuda)分离得到的一种黄酮化合物,能够提高SOD、过氧化氢酶(catalase,CAT)和谷胱甘肽过氧化物酶(glutathioneperoxidase)等抗氧化酶的活性而增强自由基清除能力,且抑制炎性因子IL-1β、IL-6和TNF-α含量及表达,降低脑组织氧化应激和炎性反应,对高原缺氧诱导脑组织损伤具有保护作用[17]。
槲皮苷(quercitrin,9)是一种广泛存在于中药鱼腥草及苹果、洋葱等水果蔬菜中的黄酮醇,可通过逆转缺氧环境下PC12细胞中p-Akt表达下降和Cleavedcaspase-3表达升高,并升高Bcl-2/Bax比值,激活Akt信号通路而提高缺氧环境下神经细胞活性并降低凋亡水平,发挥对神经细胞的保护作用[18]。
表儿茶素(L-epicatechin,10)是一种广泛存在于茶叶、葡萄等植物及儿茶、山楂、何首乌等中药中的黄烷醇类化合物,可抑制H/R损伤心肌细胞高迁移率族蛋白B(highmobilitygroupproteinB,HMGB)1/Toll样受体(tolllikereceptors,TLR)4/NF-κB信号通路HMGB1、TLR4mRNA和蛋白表达及NF-κBp65mRNA的表达,通过调控HMGB1/TLR4/NF-κB信号通路抑制缺血再灌注损伤细胞凋亡的作用[19]。
田蓟苷(acacetin-7-O-beta-D-galactopyranoside,11)是从香青兰中提取的一种天然活性成分,可通过抑制ROS产生、升高基质金属蛋白酶(matrixmetalloproteinase,MMP),激活LXR-α/Akt通路,调节P-p38MAPK凋亡通路蛋白而发挥抑制线粒体介导的内源性细胞凋亡程序,从而抑制H/R诱导的H9c2心肌细胞损伤[20]。
黄芩苷(baicalin,12)是中药黄芩中的主要有效成分,可提高细胞微miRNA-133b水平,提高细胞活力并抑制细胞凋亡,进而保护心肌细胞免受H/R损伤[21]。
三叶苷(trilobatin,13)是从多穗柯(甜茶)嫩叶中提取得到的二氢查尔酮类化合物,具有抗氧化、抗炎和抗糖尿病等活性,常被用作天然甜味剂。Wang等[22]研究发现,三叶苷可上调miRNA-539-5p表达,从而有效降低缺氧缺糖诱导的心肌细胞损伤。
2.3苯丙素类
毛蕊花糖苷(verbascoside,14)(见图3)和松果菊苷(echinacoside,15)是肉苁蓉中主要活性成分,可改善低压低氧大鼠肝脏和骨骼肌细胞水肿和炎症浸润,提高高原缺氧环境中的作业效能[23]。还可降低脑和海马组织中的MDA含量,增加GSH含量和T-SOD酶活性,减轻低压低氧引起的脑组织氧化损伤;提高海马组织中mTOR和P70S6K的mRNA和蛋白表达,降低4E-BP1的mRNA与蛋白表达以及Caspase-3的蛋白表达,通过激活低氧条件下抑制的PI3K/Akt/mTOR-HIF-1α信号通路,减轻脑组织损伤,从而发挥对高原缺氧认知功能损伤的保护作用[24]。
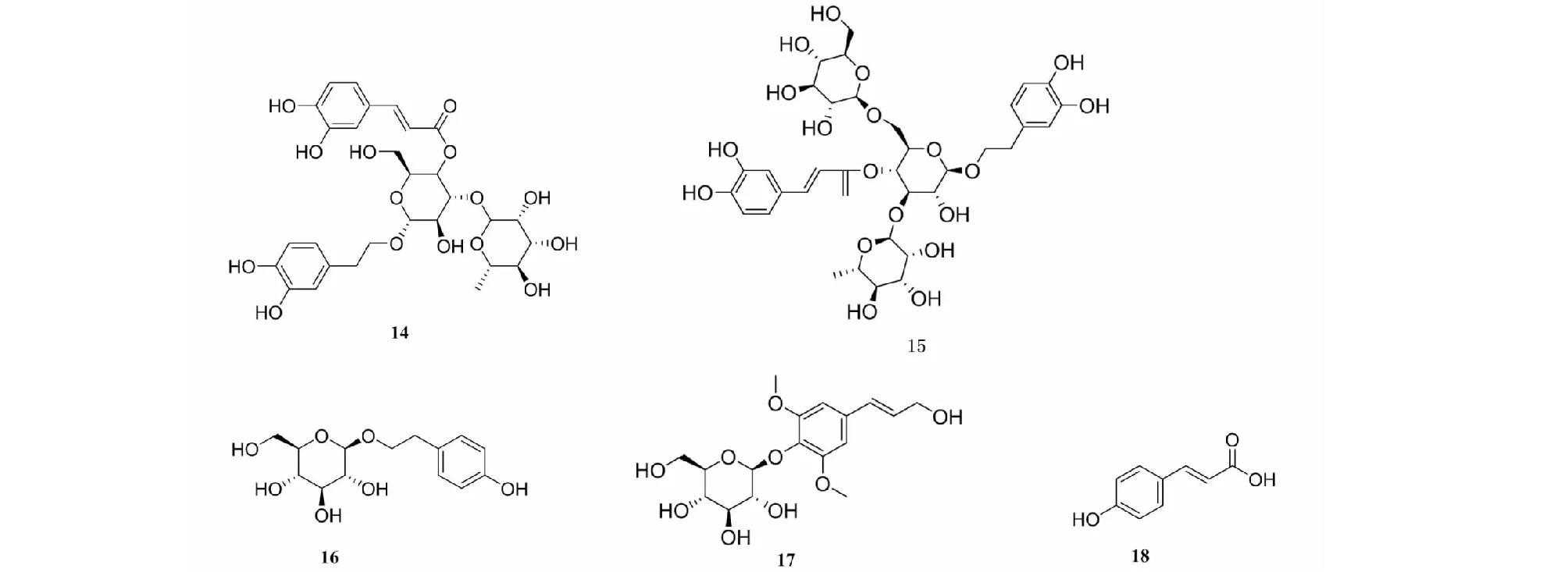
图3具有抗缺氧作用的苯丙素类单体化合物结构式
iaeffect
红景天苷(salidroside,16)是红景天中的主要活性成分,临床上用于治疗高海拔心肺疾病,可上调自噬相关蛋白Beclin-1的表达和微管相关蛋白轻链LC3Ⅱ/Ⅰ的比值,减轻自噬,减轻低氧大鼠心肌细胞及缺血缺氧大鼠海马神经元凋亡,起到心肌及神经的作用[25]。可增强CoCl2致缺氧条件下的PC12细胞活力,促进mTOR以及下游蛋白4EBP1的磷酸化水平,通过激活mTOR-4EBP1通路,从而提高ATP含量,减轻缺氧所致的PC12神经细胞损伤[26]。还可升高闭锁蛋白(occludin)和与其连接的紧密连接蛋白-1(zonulaoccludensprotein-1,ZO-1)的表达,改善缺氧缺血大鼠血脑屏障[27]。
刺五加苷B(syringin,17)为刺五加的主要活性成分之一,具有保护神经、抗缺血和抗运动型疲劳等作用。研究表明[28],刺五加苷B激活PI3K/Akt信号通路而抑制神经元凋亡,对H/R诱导的SD大鼠皮层神经元损伤具有神经保护作用。
对香豆酸(p-hydroxycinnamicacid,18)是一种广泛存在于人参、红花、菟丝子等多种中药中的苯丙酸,具有抗氧化、抗炎、保护心脏和免疫调节等作用。
Chu等[29]研究发现,对香豆酸可提高小鼠肺组织Na+/K+-ATP酶活力与抗氧化能力,降低IL-1β和IL-6等炎症因子,进而预防急性缺氧下肺水肿的产生。
2.4皂苷类
人参皂苷(ginsenoside,19)(见图4)是人参中主要的药理活性成分之一,其中人参皂苷Rg1是关键的生物活性成分,可抑制H/R导致的心肌细胞凋亡和caspase-3的活性,促进核因子红细胞2相关因子2(nuclearfactorerythroid-2relatedfactor2,Nrf2)核转录,同时可增强下游基因HO-1表达,通过激活Nrf2/HO-1信号通路保护心肌细胞[30]。
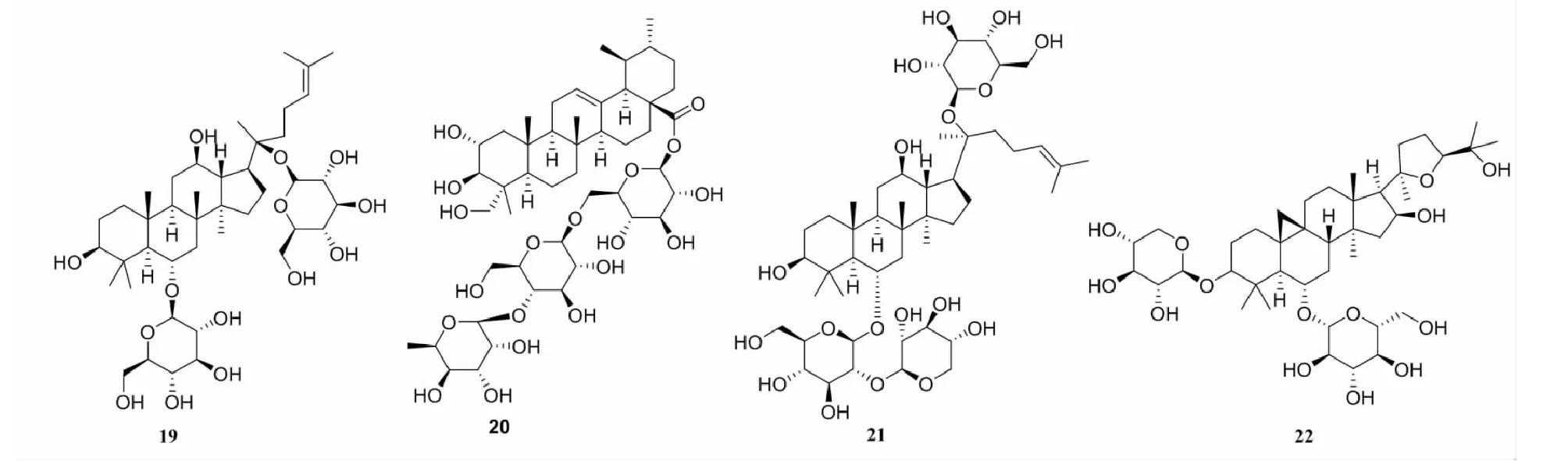
图4具有抗缺氧作用的皂苷类单体化合物结构式
积雪草苷(asiaticoside,20)为中草药积雪草五环三萜皂苷类提取物,能够减少心肌氧自由基MDA生成,增加心肌氧自由基清除剂SOD的生成等途径,增强心肌细胞抗氧化能力;通过抑制NF-κB的生成及减少心肌细胞凋亡,发挥对心肌细胞缺血缺氧损伤的保护作用[31]。
三七皂苷R1(notoginsenosideR1,21)是从中药三七中分离出来的活性成分,对神经损伤具有保护作用,可以减少脑缺血损伤小鼠的脑梗死面积,减少缺氧诱导的心肌细胞凋亡。通过下调NF-κB信号,减轻缺氧诱导PC12心肌细胞损伤[32]。
黄芪甲苷(astragalosideA,22)是一种羊毛脂醇形的四环三萜皂苷,为黄芪药材的定性定量指标,是黄芪的主要有效成分。黄芪甲苷可通过调节线粒体形态动态稳定,维持线粒体功能,抑制ROS过度合成,改善氧化应激内环境,并减轻细胞凋亡,从而发挥抗心肌细胞缺氧复氧损伤作用[33]。
2.5萜类及挥发油
龙胆苦苷(gentiopicroside,23)(见图5)属于裂环环烯醚萜类化合物,主要从龙胆科龙胆属植物龙胆和秦艽中提取,具有抗炎、保肝、利胆等作用。Chen等[34]研究发现,龙胆苦苷可通过激活AMPK/Nrf2信号通路,发挥抗氧化作用和调节机体能量代谢,进而保护缺氧缺血性脑损伤大鼠心肌线粒体,并修复心肌组织损伤。
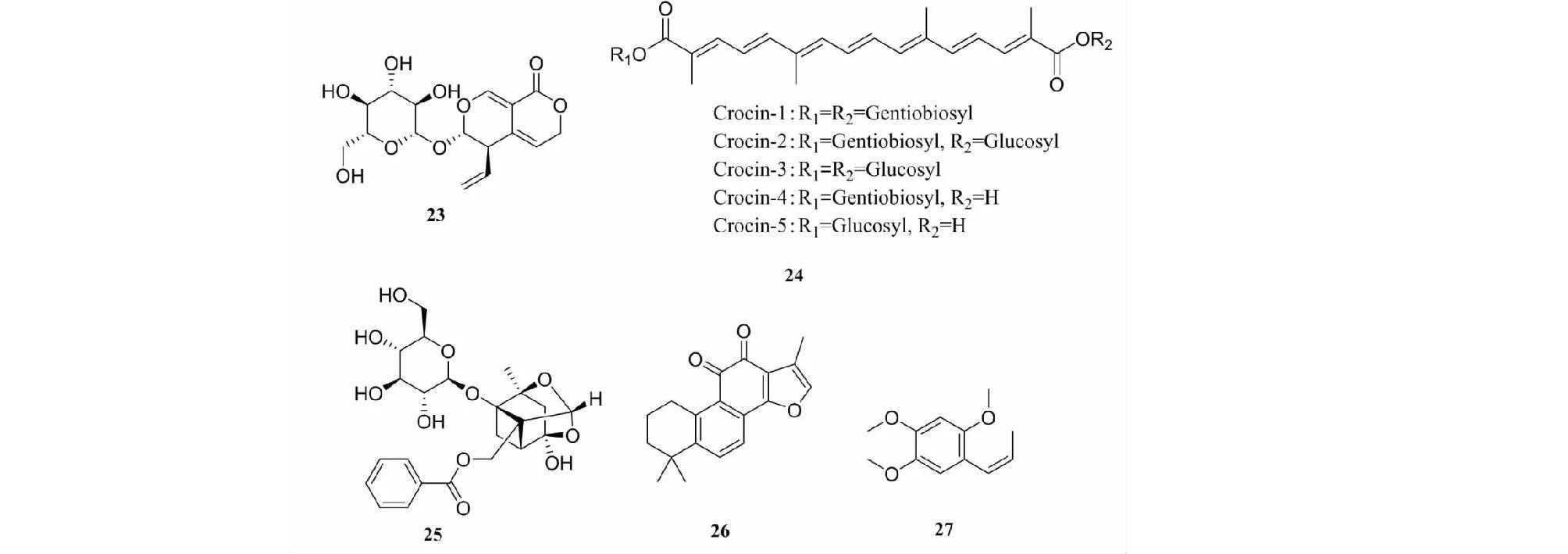
图5具有抗缺氧作用的萜类及挥发油单体化合物结构式
nti-hypoxiaeffect
西红花苷(crocin,24)是西红花的主要活性成分之一,能通过上调Bcl-2表达,下调Bax和caspase-3表达,抑制缺血缺氧损伤大鼠的心肌细胞凋亡,进而缓解心肌组织氧化应激损伤[35]。
芍药苷(paeoniflorin,25)是存在于赤芍、白芍和丹皮等中药中的一种蒎烷单萜苷,可激活SIRT1/NF-κB信号通路,降低新生大鼠脑组织的氧化应激损伤,并改善其认知功能[36]。
丹参酮ⅡA(tanshinoneⅡA,26)为二萜化合物,是丹参的主要活性成分,具有抗氧化、抗炎及保护血脑屏障等作用。可通过降低海马氧化应激水平、提高氧自由基清除能力而保护海马神经元,进而改善高原缺氧致大鼠认知功能障碍[37]。
β-细辛醚(β-asarone,27)是石菖蒲挥发油的主要成分,占挥发油成分的83.75%。β-细辛醚极易透过血脑屏障,可抑制缺血再灌注脑损伤大鼠神经细胞凋亡。Ma等[38]研究发现,β-细辛醚可作为配体结合到NMDAR,刺激NR2B基因表达升高,调节NMDAR功能并减弱NMDAR过度激活,抑制缺氧造成的细胞凋亡,产生保护缺氧损伤PC12细胞的作用。
2.6生物碱类
东莨菪碱(scopolamine,28)(见图6)是中药洋金花中的指标性成分,为M胆碱受体阻断药,临床可有效改善新生儿缺血缺氧性脑病患儿的临床症状,对重型颅脑损伤也有保护作用。Wang等[39]研究发现,东莨菪碱可下调Bax及上调Bcl-2的表达,抑制H/R诱导的心肌细胞凋亡,降低MDA、LDH和CK水平,减轻H/R诱导的心肌细胞氧化损伤,通过调控微小RNA-15b的表达而抑制PI3K/Akt信号通路的活化从而保护H/R损伤的心肌细胞。
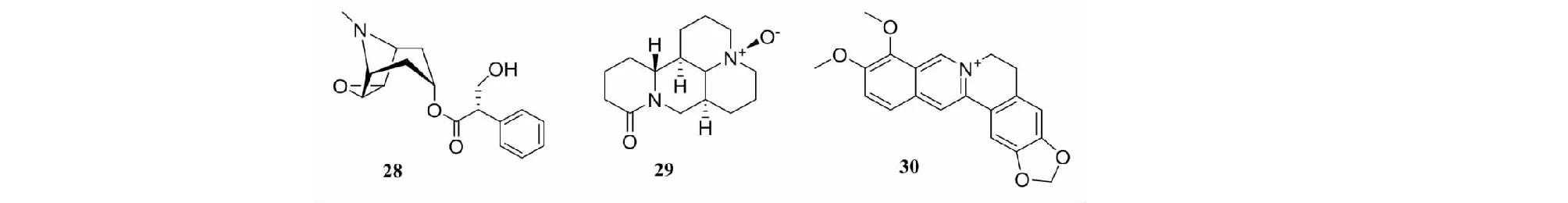
图6具有抗缺氧作用的生物碱类单体化合物结构式
t
氧化苦参碱(oxymatrine,29)是苦参中主要活性成分,具有抗炎、抗凋亡、抗氧化等药理活性明显抑制作用,临床常用于辅助治疗肝炎、肿瘤等疾病。它可通过抑制TGFβ1/Smad3通路来减轻缺氧缺血诱导的细胞线粒体功能障碍、氧化损伤和凋亡,从而保护角质形成细胞的存活,具有治疗慢性创面愈合的潜力[40]。
黄连素(berberine,30),是从黄连根茎中提取的一种生物碱,具有抗炎、抗氧化和抗癌等多种药理作用。它可上调miRNA-29b表达,负向调控其靶基因PTEN蛋白的表达,发挥其对H/R损伤H9c2细胞的保护作用[41]。
3中药提取物抗缺氧作用
Shi等[42]采用水提-醇沉法从蕨麻(PotentillaanserinaL.)中制备得到蕨麻多糖,发现蕨麻多糖可显著降低缺氧大鼠脑、肺含水量,通过降低脑、肺组织MDA和IL-1β含量,并提高SOD活性,从而有效抑制缺氧引起的脑水肿和肺水肿。铁皮石斛多糖可以清除氧自由基,升高Bcl-2、降低Bax蛋白的表达,发挥抗氧化及抗细胞凋亡作用,增强H/R损伤视网膜组织对缺血、缺氧的耐受力[43]。枸杞多糖是枸杞果实中重要活性成分,可以抑制缺糖缺氧损伤后的HK-2细胞凋亡,并促进其增殖,从而降低肾缺血缺氧损伤,其机制可能与改善线粒体功能、抑制细胞自噬蛋白表达有关[44];还可降低大鼠血清乳酸和尿素氮水平,增加肝脏和肌肉糖原含量,延长力竭游泳时间,能延长常压缺氧试验中小鼠缺氧存活时间,表明枸杞多糖具有抗疲劳和抗缺氧作用[45]。Tao等[46]发现,黄芪水提物可降低高原缺氧大鼠血清、脑、肝脏和肌肉组织BUN、LD、LDH含量,升高GSH、HG、MG含量,显著延长缺氧大鼠力竭游泳时间,对高原缺氧引起的运动能力降低具有改善作用;还可调节4E-BP1/mTOR/P70S6K信号通路,减轻氧化损伤,抑制细胞凋亡,改善海马组织CA1区组织形态,减轻神经元损伤程度,从而发挥对高原认知功能损伤的保护作用。黄芪多糖可促进p-Akt、p-mTOR、Bcl-2的表达,抑制CleavedCaspase-3、Bax、Beclin1、LC3-Ⅰ、LC3-Ⅱ、P62的表达,使Bcl-2/Bax比值显著升高,LC3-Ⅱ/LC3-Ⅰ比值显著降低,激活Akt/mTOR通路,从而抑制H/R诱导的乳鼠心肌细胞凋亡与自噬[47]。北五味子多糖能显著延长小鼠负重游泳时间及常压耐缺氧时间,降低小鼠血清乳酸和血清尿素氮的浓度,提高运动后乳酸脱氢酶活性和小鼠体内肝糖原的储备量,具有良好的抗缺氧、抗疲劳活性[48]。山药多糖可抑制缺氧的神经细胞线粒体损伤,下调Caspase-3、BaxmRNA等凋亡相关基因与蛋白的表达,上调Bcl-2mRNA及蛋白的表达,提高Bcl-2/BaxmRNA及蛋白的比例,有效抑制神经细胞缺氧性凋亡及H/R诱导的神经细胞早期凋亡[49]。党参多糖能显著改善缺氧缺血性脑损伤模型大鼠神经功能,减轻脑水肿和病理改变,其机制可能与介导Nrf2信号通路,抑制细胞凋亡,降低Bax表达,上调Bcl-2表达,增加bFGF、BDNF、PSD95、SYP、Nrf2和HO-1表达有关[50]。太子参多糖预处理心肌细胞可明显降低H/R诱导的心肌细胞LDH释放量及RIPK3表达的水平,减少心肌细胞死亡数量,减轻心肌细胞坏死的损伤程度,在H/R诱导的心肌程序性坏死中起保护作用[51]。地黄多糖能够改善抗氧化酶活性,上调抑凋亡基因Bcl-2表达、下调促凋亡基因Bax表达,提高Bcl-2/Bax表达,以及抑制促凋亡蛋白Caspase-3表达,通过抑制氧化应激损伤和细胞凋亡,对H/R损伤乳鼠心肌细胞起到一定的保护作用[52]。当归多糖可上调Nrf2表达,提高心肌细胞内抗氧自由基酶的表达,降低由H/R所导致心肌细胞的氧化应激反应,从而抑制心肌细胞凋亡[53]。灵芝多糖可以抑制H/R诱导的心肌细胞凋亡,减少ROS产生,促进超氧化物歧化酶的表达,使线粒体膜电位升高,减少线粒体细胞色素C向质的释放,保护心肌细胞免受H/R损伤[54];还可改善缺氧诱导的氧化应激,减少缺氧损伤引起的人脐静脉内皮细胞的凋亡[55]。此外,白术多糖可改善缺氧对神经细胞生长的抑制,抑制H/R诱导的神经细胞早期凋亡[56]。黄精多糖可通过抑制TLR4-MyD88-NF-κB信号通路及抑制凋亡,发挥对H/R诱导的H9c2心肌细胞的保护作用[57]。白扁豆多糖可增强H/R损伤胎鼠大脑皮层神经细胞的活性,减少细胞凋亡[58]。天冬多糖可上调E钙黏素表达,下调N钙黏素和波形蛋白表达,通过逆转缺氧诱导的上皮间质转化,抑制缺氧诱导的人肝癌细胞迁移[59]。
茶多酚是一类从茶叶中提取的多酚类复合物,具有强大的抗氧化和抗炎能力,在降压、降脂等保护心血管方面具有很好的作用。茶多酚能够降低MDA含量及增加CAT、SOD和GSH-Px的活性,减少MPO、IL-1β、TNF-α和IL-6含量,抑制MAPK/NF-κB通路相关蛋白p38、JNK、ERK1/2和p65的表达,发挥抗氧化及抗炎作用,进而保护H/R损伤的H9c2大鼠心肌细胞[60]。蕨麻正丁醇提取部位能够提高低压低氧大鼠脑组织抗氧化能力,提高对自由基的清除力,减轻膜脂质过氧化损伤,进而保护脑组织免受低压低氧损伤[61]。蕨麻多酚能够通过下调心肌细胞p53和Bax水平,上调Bcl-2表达,抑制心肌细胞凋亡,从而减轻缺氧导致的心肌损伤[62]。
Sun等[63]采用D-101大孔树脂从九龙藤分离得到其总黄酮,纯度为48.95%。后经其课题组研究发现,九龙藤总黄酮可下调LC3、P62基因及CathepsinD蛋白表达,上调P62蛋白表达,减小LC3-Ⅱ/LC3-Ⅰ比值,抑制自噬,从而减轻心肌缺血/缺氧损伤[64]。Liu等[65]采用80%乙醇超声提取得到橘络黄酮粗提物,经大孔树脂分离得到橘络黄酮,纯度为52%,并研究发现橘络黄酮可抑制细胞内TR3向线粒体移位,提高缺氧肠平滑肌细胞线粒体膜电位水平,同时降低caspase-3和caspase-8酶活性,抑制线粒体凋亡通路的活化,继而保护肠平滑肌细胞免受缺氧损伤。山楂叶总黄酮可通过调控miR-133b靶向下调RBMX的表达改善H/R诱导的神经细胞损伤[66]。刺五加总黄酮可明显抑制血清中TNF-α的表达,促进NGF和BDNF的表达,调控脑组织HDAC1和KCC2mRNA和蛋白表达,从而发挥对新生缺血缺氧性脑损伤大鼠脑组织的保护作用[67]。Gong等[68]发现,主要成分为黄酮类化合物的银杏叶提取物可降低高原低氧诱导引起的脑含水量的升高,对低氧暴露下血脑屏障通透性增高具有一定抑制作用。
人参果总皂苷是五加科植物人参()果实中主要有效成分,可通过增加细胞增殖率,减轻细胞自噬,升高SOD含量,降低MDA和LDH含量,从而减轻H/R诱导的人脐静脉内皮细胞损伤[69]。三七总皂苷是中药三七的主要活性成分,可降低自噬相关蛋白Atg5、Beclin-1表达和LC3Ⅱ/LC3Ⅰ比值,提高磷酸化的PI3K、Akt、mTOR蛋白表达,通过激活PI3K/Akt/mTOR信号通路,从而减轻H/R诱导的H9c2细胞损伤[70]。
当归挥发油可降低自噬相关蛋白Beclin-1的表达及LC3Ⅱ/LC3Ⅰ比值,通过抑制自噬而降低H/R诱导的心肌细胞损伤[71]。Li等[72]采用水蒸气蒸馏法从白术根茎中提取得到白术挥发油,发现其具有良好的DPPH清除能力,且连续灌胃白术挥发油28天能显著延长小鼠常压缺氧下存活时间和断头喘气时间,增加亚硝酸钠中毒后呼吸次数,显著降低血MDA水平并提高SOD、CAT活性,具有良好的抗缺氧作用。藏荆芥挥发油可显著延长小鼠常压耐缺氧存活时间和断头后张口喘气时间,具有良好的抗缺氧作用,还可明显延长小鼠力竭游泳时间,增加肝糖原和肌糖原含量,具有良好的抗疲劳作用[73]。
麻花秦艽醇提物可提高高原缺氧大鼠心肌组织和脑组织SOD及CAT活性,降低MDA和NO含量,提高心肌及脑抗氧化能力;降低脑组织中乳酸脱氢酶的活力和乳酸的含量,升高心肌及脑组织ATP酶活性及含量,升高心肌组织Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶含量,调节心肌及脑能量代谢;降低肺组织炎症相关因子IL-6、IL-1β、TNF-α的含量,从而降低高原缺氧导致的心肌、脑及肺损伤[74]。矮垂头菊乙醇提取物在体外具有良好的自由基清除活性,尤其是对超氧阴离子的清除作用优于维生素C,能够显著延长缺氧常压密闭小鼠的存活时间,提高缺氧小鼠心脑组织中SOD、CAT和GSH-Px的活力,对缺氧小鼠心脑组织损伤具有良好的保护作用[75]。丹参水提取物可通过激活PI3K/Akt信号通路,提高Akt蛋白的磷酸化和Bcl-2/Bax比值,减轻心肌细胞的凋亡,进而发挥对急性心肌缺氧缺血大鼠的保护作用[76]。
4中药复方抗缺氧作用
中药复方是由两味或两味以上药味配伍组成,其以低毒、高效、安全的优势在抗缺氧损伤的药物研发中发挥着重要作用。复方中不同药物的化学成分协同作用于机体,可以多靶点、多层次发挥抗氧化、抗凋亡和调节细胞能量代谢等作用,改善由缺氧引起的机体各部位损伤,继而抑制缺氧相关疾病的发生发展。如生脉散可降低急性缺氧引起的血清促红细胞生成素、心钠素、N-脑钠肽、肾素、血管紧张素Ⅱ及醛固酮含量的升高,从而预防急性高原病[77]。相关抗缺氧中药复方及其作用机制见表1。
表1抗缺氧中药复方及其作用机制
Table1Anti-hypoxiaChineseherbalcompoundanditsmechanism

续表1()

5结论与展望
缺氧可诱发炎症、氧化损伤、血管内皮细胞损伤和自噬凋亡等,进而引起机体脑损伤、肺损伤及心肌损伤等,导致一系列疾病的发生与恶化。西医临床用于抗缺氧的常用药存在禁忌证较多、不良反应强等缺点,而中药作为中国的医学瑰宝,不仅不良反应小且具有多层次、多靶点、多通路的优势,在预防和治疗缺氧导致的高原病、心血管疾病和记忆损伤等方面极具应用前景。多酚类、黄酮类、皂苷类、苯丙素类、生物碱类和萜类等源于中药的天然单体化合物在抗缺氧损伤方面展现了较好的生物学活性;随着现代分离技术的发展和深入评估,中药提取物的原创性优势和较高的技术含量,在抗缺氧的治疗方面有着巨大潜力;中药复方将多种有效成分融合,通过多靶点、多通路多层次,针对不同诱因、不同组织部位的缺氧损伤及不同损伤类型的复杂疾病治疗具有独特优势。
然而,大部分对中药单体化合物、中药提取物及中药复方制剂的研究还停留在临床前的药效学研究阶段。此外,相比于西药,中药起效慢,缺乏对临床应用安全性及疗效的评估。因此,中药在防治缺氧损伤方面的临床应用还有待进一步的研究,后期应当将基础研究与临床应用结合,进一步确定中药抗缺氧损伤的作用及机制。综上所述,中药的单体化合物、提取物及复方制剂的多水平、多方向研究能更精准地为缺氧损伤相关疾病的治疗开辟新的途径及思路,寻找多靶点、多层次、多通路调控预防及对抗缺氧损伤的药物,为临床治疗缺氧相关疾病提供重要的理论依据。
参考文献
1CarreauA,?Smallmoleculesandhypoxia[J].JCellMolMed,2011,15:1239-1253.
2RenSS,,migrationandinvasionbyup-regulatingmiR-200b/cinbreastcancerunderhypoxia[J].JExpClinCancerRes,2019,38(1):388.
3WuSH,ing-stateBOLD-fMRIvoxel-mirroredhomotopicconnectivity[J].ChinImagJIntegrTraditWestMed(中国中西医结合影像学杂志),2019,17:445-447.
4HouXF,dativestressandcellapoptosis[J].JBiomedEng(生物医学工程学杂志),2012,29:727-731.
5ShiWB,hypothalamicneuronalinjuryinratswithchronicstress[J].ChinJAnat(解剖学杂志),2018,41:280-284.
6IzzottiA,[J].MutatRes,2006,612:105-114.
7JiangP,[J].CellRes,2014,24(1):69-79.
8MarholdM,αregulatesmTORsignalingandviabilityofprostatecancerstemcells[J].MolCancerRes,2015,13:556-564.
9DangSS,swithhypoxic-ischemicbraininjuryviaPI3K/Akt/mTORpathway[J].ProgModBiomed(现代生物医学进展),2020,20:1820-1823.
10ChenNN,natalrats[J].ChinJIntegrMedCardio-CerebrovascDis(中西医结合心脑血管病杂志),2020,18:3574-3577.
11DangH,tretinalimpairment[J].RecAdvancesOphthalm(眼科新进展),2018,38:940-942.
12ZhaiBZ,ZhangLJ,LiuZ,/reoxygenationinjuryinLLC-PK1cellsviaNa/K-ATPase/Srcsignalingpathway[J].FoodSci(食品科学),2021,42(15):136-142.
13LiuC,/reoxygenationinjuryofcardiomyocytesculturedinvitrowithpaeonolbyinhibitingmiR-155-5p[J].ActaUnivSciMedChongqing(重庆医科大学学报),2021,46:156-161.
14ChenP,/Aktsignalingpathwaytoprotecthypoxia/effectsofreoxygenationonblood-brainbarrierfunction[J].TianjinJTraditChinMed(天津中医药),2021,38:387-392.
15YuH,ncardiomyocytesinducedbyhypoxia/reoxygenation[J].ChinJTissueEngRes(中国组织工程研究),2020,24:5613-5618.
16ZhangMM,diomyocytesbyPI3K-Akt/m-TORsignalingpathway[J].JChinMedMater(中药材),2020,43:1449-1454.
17LiuR,tingoxidativestressandinflammation[J].NatProdResDev(天然产物研究与开发),2020,32:1413-1418.
18LiWN,aktsignalingpathway[J].PharmBiotechnol(药物生物技术),2020,27:300-304.
19YuCN.(-)-Epicacatechinrepairshypoxia/reoxygenationinjuryofcardiacmyocytesthroughinhibitingHMGB1signalingpathway[J].GuangzhouJTraditChinMed(广州中医药大学学报),2020,37:2418-2423.
20LiHN,/reoxygenationinjury[J].ChinJInfTraditChinMed(中国中医药信息杂志),2021,28:76-80.
21CuiCT,s[J].ChinJIntegrMedCardio-CerebrovascDis(中西医结合心脑血管病杂志),2021,19:565-568.
22WangDY,cardiomyocyteinjurybyregulatingtheexpressionofMiR-539-5p[J].ChinaPharm(中国药师),2021,24:462-467.
23LiM,[J].PhytotherRes,2019,33:2692-2701.
24/Akt/mTOR-HIF-1αsignalingpathwayinhippocampusofratsandimprovementofverbascoside[D].Lanzhou:GansuUniversityofChineseMedicine(甘肃中医药大学),2020.
25MaL,[J].ChinJClinPharmacol(中国临床药理学杂志),2020,36:3450-3453.
26ZhongXY,disorderinPC12cells[J].FujianJTraditChinMed(福建中医药),2020,51:36-38.
27LiJ,icbraininjury[J].ChinJNeuroanat(神经解剖学杂志),2019,35:510-514.
28DengFC,byhypoxia/reoxygenationinSDratsandtheimpactonPI3K/Aktsignalingpathway[J].ChinMedPharm(中国医药科学),2020,10:237:37-40.
29ChuBQ,yedemamice[J].ChinPharmJ(中国药学杂志),2018,53:1463-1469.
30LiQH,/reoxygenationinjuryanditsmechanism[J].ChinaJChinMaterMed(中国中药杂志),2021,46:1460-1466.
31WangC,myocytesinsucklingmice[J].ClinResTraditChinMed(中医临床研究),2020,12:23-25.
32RenM,2cells[J].ChinJClinPharmacol(中国临床药理学杂志),2020,36:1657-1660.
33LiuAM,/reoxygenationinjuryviaregulatingmitochondrialhomeostasisinratcardiomyocytes[J].ActaPharmSin(药学学报),2020,55:2398-2404.
34ChenJL,α1andNrf2onmyocardialinjuryandmitochondrialfunctionofratswithhypoxic-ischemicbraindamage[J].GuangzhouJTraditChinMed(广州中医药大学学报),2020,37:2394-2400.
35HuangJC,ypoxiainratsanditsmechanism[J].JJilinAgrUniv(吉林大学学报),2021,47:102-109.
36LiuYX,oxic-ischemicbraindamage[J].ChinJClinPharmacol(中国临床药理学杂志),2020,36:3992-3994.
37HuoJL,ⅡAonhighaltitudehypoxia-inducedcognitivedeficitsinrats[J].ChinJNeuroanat(神经解剖学杂志),2019,35:505-509.
38MaJ,β-asaroneonexpressionofNMDARsubunitsinhypoxiainjuredPC12cells[J].TraditChinDrugResPharmacol(中药新药与临床药理),2020,31:1015-1020.
39WangHL,ypoxia/reoxygenationbydown-regulatingtheexpressionofmiR-15b[J].JToxicol(毒理学杂志),2020,34:486-491.
40LiuSD,hypoxiaischemia[J].JShandongUniv:HealthSci(山东大学学报:医学版),2021,59:26-34.
41LuYR,/reoxygenation-inducedinjuryinH9c2cellsviamiR-29[J].JHebeiMedUniv(河北医科大学学报),2021,42:256-261.
42charide[D].Lanzhou:NorthwestNormalUniversity(西北师范大学),2020.
43XiaoYJ,lsdamageduetohypoxia/reoxygenation[J].ChinaJChinOphthalmol(中国中医眼科杂志),2020,30:613-617.
44YanWY,autophagyofHK-2cellsafterhypoglycemiaandhypoxiainjury[J].ChinJClinPharmacol(中国临床药理学杂志),2020,36:4010-4012.
45WuM,es[J].2015:686-689.
46poxicexerciseandbehavioralcognitioninplateau[D].Lanzhou:LanzhouUniversity(兰州大学),2020.
47osisandautophagyinneonatalratsinjuredbyhypoxia/reoxygenation[J].ShanxiJTraditChinMed(陕西中医),2021,42:561-564.
48ZhangZY,i-hypoxiainmice[J].JNortheastForestUniv(东北林业大学学报),2011,39(12):98-99.
49XiangQ,/reoxygenation[J].PharmClinChinMaterMed(中药药理与临床),2013,29(3):94-97.
50MaJ,charidesonhypoxic-ischemicbraininjuryinducedbyNrf2pathway[J].ChinJClinAnatomy(中国临床解剖学杂志),2019,37:403-408.
51/reoxygenation-inducedcardiomyocytenecroptosis[D].Zhenjiang:JiangsuUniversity(江苏大学),2018.
52PengH,poptosisofneonatalratcardiomyocytesimpairedbyhypoxia-reoxygenation[J].ChinJExpMedForm(中国实验方剂学杂志),2016,22(23):155-160.
53HuoLC,cytesdamagedbyhypoxia-reoxy?genation[J].SouthChinaJCardiovascDis(岭南心血管病杂志),2019,25:579-585.
54LiWJ,/reoxygenation-inducedoxidativestressbymitochondrialpathway[J].JCellBiochem,2010,110(1):191-200.
55ZhangYS,/reoxygenation-mediatedoxidativestressandapoptosisinhumanumbilicalveinothelialcells[J].IntJBiolMacromol,2017,98:398-406.
56HuWX,cityandanti-apoptosisinducedbyhypoxia/reoxygenation[J].PharmClinChinMaterMed(中药药理与临床),2014,30(3):89-91.
57LeiSP,ellsinjuryinducedbyhypoxiaandreoxygenation[J].PharmClinChinMaterMed(中药药理与临床),2017,33(1):102-106.
58ZhangXY,(DolichoslablabL.)onhypoxia-inducedneuronalapoptosis[J].FoodSci(食品科学),2018,39(3):222-228.
59ChengW,arcinomacellsbyreversingepithelial-mesenchymaltransitionunderhypoxia[J].LiaoningJTraditChinMed(辽宁中医杂志),2019,46:2127-2130.
60ChenLH,cardiomyocytesinjuryinducedbyhypoxia/reoxygenation[J].MilitMedJSoutheastChina(东南国防医药),2020,22:228-233.
61WangLJ,[J].JLogisticsUnivPAP:MesSci(武警医学院学报:医学版),2011,20:169-172.
62ChenF,sofrats[J].ChinaPharm(中国药师),2020,23:1016-1021.
63SunY,dsfromBauhiniachampionii[J].ChinJExpMedForm(中国实验方剂学杂志),2014,20:29-32.
64YangXF,injurybyinhibitingautophagy[J].ChinPharmBull(中国药理学通报),2020,36:978-983.
65LiuJJ,anintestinalsmoothmusclecellsandthemechanism[J].JThirdMilMedUniv(第三军医大学学报),2020,42:594-600.
66LiLJ,tion-inducedneuronaldamageviamiR-133bregulation[J].ChinTraditPatMed(中成药),2020,42:1443-1449.
67WangKW,intissueofneonatalratswithhypoxic-ischemicbraindamage[J].ChinJClinPharmacol(中国临床药理学杂志),2020,36:624-627.
68GongYX,hypoxia[J].ClinJMedOfficer(临床军医杂志),2010,38:327-329.
69LiLJ,hypoxiaandreoxygenation[J].GinsengRes(人参研究),2020,32(6):6-9.
70WangP,anoxia/reoxygenationinjuryviaPI3K/Akt/mTORsignalingpathway[J].ChinJInfTraditChinMed(中国中医药信息杂志),2021,28(8):87-92.
71PuYP,phagyofmyocardialcellH9c2inratswithhypoxia/reoxygenationinjury[J].ChinaPharm(中国药房),2020,31:2492-2497.
72LiX,tyofmice[J].JHunanNormalUni:MedSci(湖南师范大学学报:医学版),2012,9(3):17-20.
73GongYL,ifoliainmice[J].JQingdaoUnivSciTech:NatSci(青岛科技大学学报:自科版),2014,35(3):262-264.
74WuXJ,[J].ChinJTraditChinMedPharm(中华中医药杂志),2020,35:3383-3388.
75JinLL,diumhumileanditsprotectiveeffectonmiceunderhypobarichypoxiacondition[J].NatProdResDev(天然产物研究与开发),2015,27:1815-1820.
76ZhangDT,yocardialhypoxiaandischemiathroughregulationofPI3K/Aktsignalpathway[J].ChinaPractMed(中国实用医药),2015,10(13):282-284.
77ZhangJX,emicalindexesinacutehypoxicrats[J].MedJNatlDefForcesSouthwestChina(西南国防医药),2018,28:701-703.
78LinS,a-reoxygenationinjuryinH9c2cells[J].ChinJIntegrMed,2019,25:439-445.
79ChenY,/reoxygenationinducedcardiomyocyteinjurybyimprovingmitochondrialdysfunction[J].TianjinJTraditChinMed(天津中医药大学学报)2020,39:576-581.
80SongBH,ryincardiacarrestratsanditsmechanism[J].ChinJGerontol(中国老年学杂志),2020,40:4427-4429.
81LongLZ,xia/reoxygenation[J].ModTraditChinMedMaterMedWorldSciTechnol(世界科学技术-中医药现代化),2021,23:2261-2268.
82TangP,[J].ChinTraditPatMed(中成药),2021,43:760-765.
83ChenF,reactivatedSH-SY5Yinjury[J].JPractTraditChinInternMed(实用中医内科杂志),2021,35(6):102-105.
84HuoJ,oxiacerebralinjury[J].WestJTraditChinMed(西部中医药),2018,31:29-31.
85XuXQ,mice[J].ChinJVetMed(中国兽医学报),2005:208-210.
86LiX,poxiatoleranceinmice[J].ChangchunJTraditChinMed(长春中医药大学学报),2020,36:268-271.
87CaoY,boratoryMice[J].PharmJChinPLA(解放军药学学报),2011,27:307-310.
88WangLM,andanti-fatigue[J].JGuizhouMedUniv(贵阳医学院学报),2012,37:249-251.
89YuanY,,hypoxia-toleranceinmice[J].JPharmPract(药学实践杂志),2008,26:430-431.
90,anti-fatigueandhypoxicmyocardialproteinexpressionofNewHuangqi-Fulingcompoundrecipe[D].Chengdu:ChengduUniversityofTraditionalChineseMedicine(成都中医药大学),2018.
91[D].Beijing:ChinaAcademyofChineseMedicalSciences(中国中医科学院),2015.
92,AKT,caspase3,caspase8expressionafterhypoxia/reoxygenationinvitro[D].Changsha:HunanUniversityofChineseMedicine(湖南中医药大学),2017.
93ZhouCG,hypoxia/reoxygenationH9c2cardiomyocytemitochondriainjury[J].ChinTraditPatMed(中成药),2016,38:658-661.
94ZhuJ,byhypoxiaandreoxygenation[J].GuangdongPharmUniv(广东药科大学学报),2017,33(1):77-83.
95LiuSC,ofcardiacmicrovascularothelialcellsinratswithhypoxia/reoxygenation[J].ChinJInfTraditChinMed(中国中医药信息杂志),2021,28(6):65-69.
96LiMD,nvitroblood-brainbarrierandrelatedregulatoryproteins[J].ChinJTraditChinMed(中华中医药学刊),2022,40(1):80-84.
97MaYZ,g-Gao-Yuan-Bing-Fang[J].MedJAirForc(空军医学杂志),2020,36(3):226-230.
98MaY,ngtohypoxia/reoxygenationinjuryofmyocardialcellsanditsconnectionswithHSP70[J].WestJTraditChinMed(西部中医药),2018,31(4):10-14.
99MengPP,edtosimulatedhigh-altitudehypoxia[J].MedJChinPLA(解放军医药杂志),2020,5:9-13.
Researchprogressofanti-hypoxicChinesemedicine
WANGWei-gang1,2,3,YANGZhi-qiang2,3,4,LIXiao-lin2,3,LIMao-xing1,2,3,4*
1CollegeofPharmacy,GansuUniversityofChineseMedicine,Lanzhou730000,China;2DepartmentofClinicalPharmacy,the940thHospitalofJointLogisticSupportForceofPLA;3GansuPlateauPharmaceuticalTechnologyCenter,Lanzhou730050,China;4InstituteofChemicalTechnology,NorthwestMinzuUniversity,Lanzhou730030,China
Abstract:,respiratorydiseases,cardiovasculardiseasesandotherinternalandexternalfactorscanleadtomitochondrialdamage,energymetabolismdisorder,oxidativestress,inflammationandaseriesofreactions,,alargenumberofstumpound,extractsandcompoundsofChinesemedicine,providingideasforthein-depthstudyanddevelopmentofanti-hypoxiaChinesemedicine,andprovidingreferenceforitsclinicalapplication.
Keywords:anti-hypoxia;hypoxiainjury;monomericcompound;Chinesemedicineextracts;Chinesemedicinecompounds
中图分类号:R932
文献标识码:A
文章编号:1001-6880(2022)2-0344-14
DOI:10.16333/
收稿日期:2021-05-14接受日期:2021-08-31
基金项目:甘肃省重点研发项目(20YF3FA035);拔尖培育项目(2021yxky001);甘肃省卫生行业科研计划(GSWSKY2020-41);“新冠肺炎(COVID-19)”应急医学科研项目(20yjky018)
版权声明:本站所有作品(图文、音视频)均由用户自行上传分享,仅供网友学习交流,不声明或保证其内容的正确性,如发现本站有涉嫌抄袭侵权/违法违规的内容。请举报,一经查实,本站将立刻删除。