近期,福建医科大学附属协和医院胃外科黄昌明教授领衔、林建贤副主任医师为第一作者的研究团队在JAMANetwOpen发表了“阿帕替尼联合SOX新辅助治疗局部进展期胃癌”的多中心研究结果。
他们发现,在局部进展期胃癌治疗中,阿帕替尼联合S-1+奥沙利铂是一种安全有效的新辅助治疗方法。这项多中心研究首次前瞻性地探索了阿帕替尼联合SOX方案新辅助治疗局部进展期胃癌的安全性及有效性,并证实该新辅助化疗方案安全可控,具有较好的临床疗效。这一发现填补了分子靶向治疗联合化疗在局部进展期胃癌术前治疗领域中的空白,是分子靶向治疗应用于胃癌治疗上的又一例证,同时也为未来进一步的研究提供了宝贵的前期研究基础。

2018年,全球记录的胃癌新病例超过100万例,因胃癌死亡人数估计为78.3万例,使胃癌成为第五大最常诊断的癌症和第三大癌症死亡原因[1]。大多数早期胃癌经内镜或手术切除可治愈,5年总生存率(OS)在90%以上[2]。相比之下,局部进展期胃癌(GC)即使在原发肿瘤和区域淋巴结全部切除后,预后仍较差[3]。因此,人们寄希望于多模式治疗局部进展期胃癌以延长生存期。自2006年MAGIC试验首次证明围手术期化疗(盐酸表柔比星、顺铂和氟尿嘧啶)与单纯手术相比可将5年OS率从23%提高到36%[4],全身化疗已成为局部晚期胃癌的标准治疗方法[5]。在亚洲,口服化学药物氟嘧啶(例如,S-1或卡培他滨)+奥沙利铂是一线方案[6,7]。然而,由于肿瘤的异质性,化疗对胃癌的疗效低于对其他实体恶性肿瘤的疗效[8,9]。因此,迫切需要新的、有效且安全性可接受的治疗方案。
在过去的十年中,一些临床试验探索了分子靶向治疗在晚期胃癌中的应用。VEGF高水平表达是胃癌的特征之一,靶向VEGF是一种潜在的治疗策略。阿帕替尼是一种新型受体酪氨酸激酶抑制剂,选择性靶向VEGF受体2(VEGFR2),已被证明能抑制VEGF介导的内皮细胞迁移、增殖和肿瘤微血管密度[10]。一项Ⅲ期研究显示,与安慰剂相比,阿帕替尼可改善化疗难治性晚期或转移性胃腺癌或胃食管交界处癌(GEJ)患者的OS和无进展生存期[11]。
新辅助化疗可降低肿瘤分期,提高R0切除率,为晚期胃癌患者提供生存益处。然而,阿帕替尼联合化疗用于新辅助治疗的证据较少。因此,福建医科大学附属协和医院黄昌明教授牵头开展了本项非随机对照试验,研究阿帕替尼联合S-1+奥沙利铂(SOX)作为局部进展期胃癌新辅助治疗的有效性和安全性[12]。(试验登记号::NCT03192735)
研究方法
该研究为多中心、单臂、开放标签、Ⅱ期、非随机对照试验,在中国南方10个中心开展。所有入组患者术前接受2~5个周期、术后6个周期的阿帕替尼+SOX治疗,3周为一个周期,用药方案包括:(1)口服阿帕替尼,500mg,每日一次,第1~21天(仅在手术前最后一周期停药);(2)S-1口服,体表面积1.25m2,剂量为40mg;体表面积1.25~1.5m2,剂量为50mg;体表面积1.5m2,剂量为60mg,1日2次,口服,服药14天,停药7天,21天为1个周期;(3)奥沙利铂130mg/m2,21天为1个周期,每周期第1天用药,静脉滴注。患者在新辅助治疗完成后2~4周进行手术。试验中,在开始第三个周期之前首次进行肿瘤反应评估,肿瘤反应良好的患者在治疗结束后接受手术治疗,肿瘤反应较差的患者再接受2个周期的新辅助治疗,然后再评估手术的可行性。
研究的主要终点是R0切除率,定义为切缘无残留的患者比例;次要终点包括缓解率、毒性反应和手术结果。
研究结果
疗效
在完整的分析集中,48例患者中有36例接受了胃癌根治性切除术,R0切除率为75.0%(48例患者中有36例接受了R0切除率;95%CI:60.4%~86.4%)。在符合方案集中,R0切除率为90.0%(40例患者中36例;95%CI:76.3%~97.2%)。
44例患者(91.7%)符合放射学评估条件,4例患者(8.3%)在1个周期后停止治疗而未接受CT扫描。20例患者(45.5%)有靶病灶,其中完全缓解1例(5.0%),部分缓解14例(70.0%),病情稳定4例(20.0%),进展1例(5.0%),放射学缓解率为75.0%。24例无靶病灶的患者中,3例(12.5%)病情进展,无完全缓解。在病情进展的患者中,1例(33.3%)基线淋巴结病变进展,2例(66.7%)有新的靶淋巴结,1例(33.3%)有新的转移性肝脏病变。44例前、后CT分期比较显示,16例(36.4%)出现T降期,其中T4降期至T3期有10例(62.5%),T4降期至T2期有4例(25.0%),T4降期至T1期有2例(12.5%);41例患者中有4例(9.8%)出现N分期降期(表1)。
表1.新辅助治疗后的肿瘤降期

进行手术的患者的病理缓解情况如图1所示。26例患者的病理缓解等级为Ⅰb级或更高,病理缓解率为54.2%(95%CI:39.2%~68.6%)。12例患者出现主要病理缓解(25.0%;95%CI:13.6%~39.6%),3例患者完全病理缓解(6.3%;95%CI:1.3%~17.2%)。在达到放射学缓解的患者中,病理缓解率为80%(12/15),主要病理缓解率为33.3%(5/15),提示病理缓解并不总是与影像学缓解一致。图1描述了手术患者根据术前周期分层的病理缓解情况。完成3个周期的患者多数病理缓解和主要病理缓解,提示该时间点可能是评价治疗效果的理想时间点。
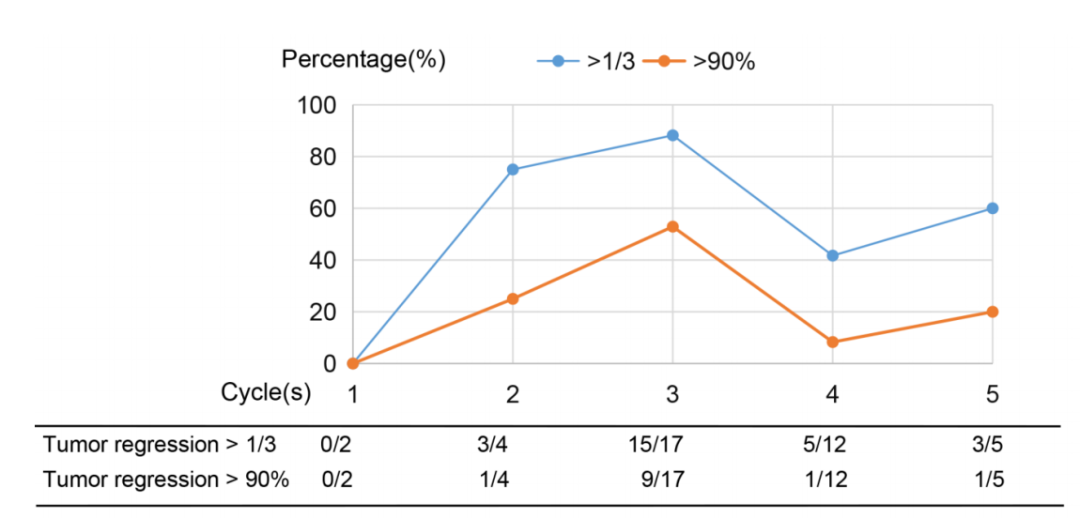
图1.根据治疗周期进行手术的患者的病理缓解情况
手术的结果
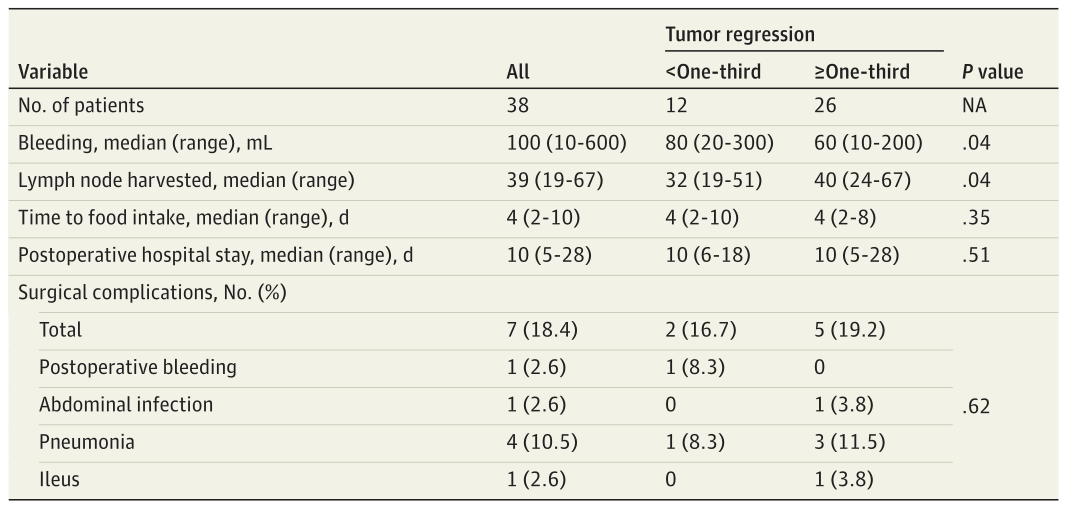
所有患者均行D2淋巴结切除术。全胃切除33例(86.8%),远端胃切除5例(13.2%)。表2详细说明了手术结果。淋巴结清扫的中位数(范围)为39(19~67)。术中出血量中位数(范围)为100(10~600)ml。术后平均住院时间为10(5~28)天。38例患者中有7例(18.4%)发生术后并发症,其中肺炎4例(57.1%),术后出血1例(14.3%),腹部感染1例(14.3%),肠梗阻1例(14.3%)。所有并发症分类为Clavien-DindoⅡ级。30天内未观察到再入院、再手术或术后死亡。
表2.手术的结果
病理缓解与患者特征之间的联系
为了进一步确定哪些患者更可能从阿帕替尼联合SOX中获益,研究人员比较了获得病理缓解的患者和未获得病理缓解的患者之间的基线特征。结果显示,东部肿瘤协作组体能状态评分为0(20[76.9%][45.5%];P=0.03)或者肿瘤位于胃上1/3(16[61.5%]vs7[31.8%];P=0.04)的患者的病理缓解率明显更高(图2)。此外,达到病理缓解的患者与未达到病理缓解的患者相比,失血量显著更少(中位数[范围]:60[10~200][20~300]ml;P=0.04),淋巴结切除更多(中位数[范围]:40个[24~67]淋巴结个[19~51]淋巴结;P=0.04),提示获得病理缓解与较好的手术结果相关。

图2.Logistic回归模型中不同基线特征患者的病理缓解情况
不良反应
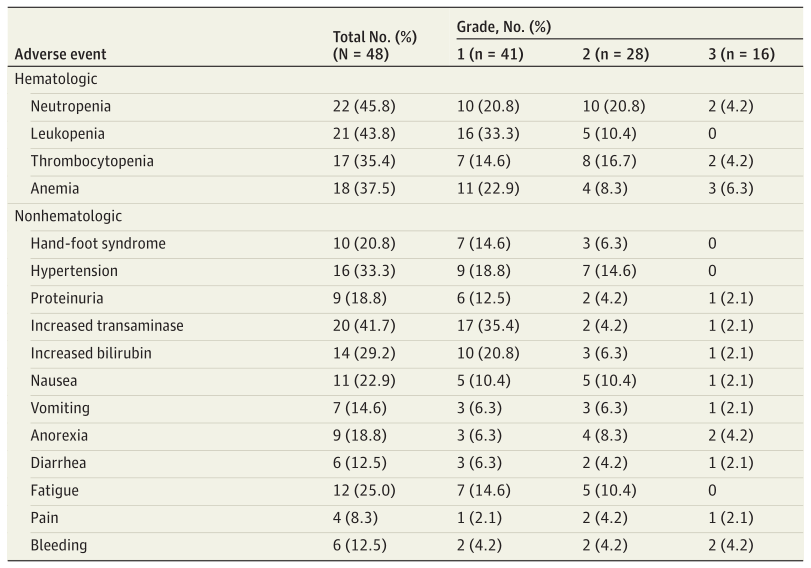
表3列出了阿帕替尼加SOX组患者手术前的AEs。最常见的毒性反应是中性粒细胞减少(22例,45.8%),其次是白细胞减少(21例,43.8%)、转氨酶升高(20例,41.7%)和贫血(18例,37.5%)。高血压16例(33.3%),手足综合征10例(20.8%),蛋白尿9例(18.8%)。共有16例患者(33.3%)发生了3级AEs,最常见的(1例)为中性粒细胞减少(2例,4.2%)、血小板减少(2例,4.2%)、厌食(2例,4.2%)和出血(2例,4.2%)。未观察到4级AEs或术前死亡病例。发生3级AEs的患者的平均手术前周期数明显低于未发生3级AEs的患者(2.7个周期;P=0.009),提示AEs的发生率与全身药物的累积暴露无关。
表3.阿帕替尼加SOX组患者手术前的AEs
讨论
这项非随机对照试验是全球首个探讨阿帕替尼联合化疗作为局部进展期胃癌新辅助治疗有效性和安全性的多中心前瞻性试验。在2017年7月1日至2019年6月30日期间,共招募了来自10个中心的48例既往未接受过抗癌治疗的患者。36例患者行胃癌根治性切除术,R0切除率为75.0%。病理缓解率54.2%,主要病理缓解率25.0%。毒性作用和手术并发症均在可控范围内,无药物相关或术后死亡。这些发现支持使用阿帕替尼加SOX作为局部进展期胃癌的新辅助治疗。
一些研究已经证明了VEGFR2抑制剂在胃癌或GEJ癌中的有效性,其中,阿帕替尼似乎是更有前途的抗血管生成剂。一项纳入267例进展期胃癌或GEJ腺癌患者的随机、双盲、安慰剂对照的3期试验显示,阿帕替尼显著改善OS(6.5个月;P=0.02)和无进展生存期(2.6个月;),安全性可接受[11]。一项涉及29例局部进展期胃癌患者的单臂Ⅱ期试验中,阿帕替尼联合SOX并随后进行手术显示了良好的抗肿瘤活性和可管理的安全性[13]。而本项多中心前瞻性研究是为了调查在更普遍的人群中相同剂量的阿帕替尼加SOX的有效性和安全性,并确定最佳的新辅助治疗周期数。
手术是胃癌治疗的基石。R0切除被认为是手术的目标,尤其是局部进展期胃癌[14-16]。因此,R0切除率是本研究的主要终点。如既往报道,术前化疗与局部晚期GC患者R0切除率增加相关。在本研究中,在全分析集中,虽然R0切除率为75%(95%CI:60.4%~86.4%),低于既往研究的结果(Al-BatranSE等研究中ECF/ECX方案组为74%,FLOT4组为85%;WangX等的研究中为91.8%,OkiE等的研究中DS方案组为93.6%)[17-19],但在符合方案集中,R0切除率达到90%(95%CI:76.3%~97.2%),达到了预期的效果。
治疗缓解率,包括放射学缓解和病理缓解,是本研究的次要终点之一。在本试验中,26例患者(54.2%)被评估为有病理缓解,12例患者(25.0%)被评估为有主要病理缓解。这些数据证实了阿帕替尼联合化疗的有效性。研究还发现,肿瘤位于胃上三分之一的患者的病理缓解率明显较高,这可能与其独特的生物学特性有关。此外,东部肿瘤协作组体能状态得分为0与较高的病理缓解率显著相关,提示体能状态可能与治疗缓解有关。这些结果为在未来的研究中确定哪些患者对阿帕替尼联合SOX更有益提供了证据。
新辅助化疗似乎与手术发病率和死亡率有关。本研究中,术后并发症结果与Shrikhande等人的研究[20]一致,新辅助治疗后D2胃切除术可以安全地应用于局部晚期胃癌患者。获得病理缓解的患者失血量明显更少,淋巴结切除明显更多,这表明获得病理缓解与更好的手术结果相关。
高血压、手足综合征和蛋白尿是抗血管生成药物中最常见的不良反应。而在本研究中,阿帕替尼加SOX最常见的AEs为中性粒细胞减少(45.8%)、白细胞减少(43.8%)、转氨酶升高(41.7%)和贫血(37.5%)。这些数据表明,阿帕替尼联合SOX的毒性作用主要是SOX相关的毒性作用。因此,目前的研究结果支持阿帕替尼加化疗的良好耐受性。
对于局部晚期胃癌的最佳新辅助治疗周期数目尚未达成共识。在本试验中,大部分病理缓解和主要病理缓解发生在完成3个周期的患者中,这可能部分是因为肿瘤反应良好的患者在完成3个周期后更有可能进行手术。这些结果也提示治疗敏感的患者在接受3个周期的治疗后可以获得良好的肿瘤反应;然而,对于难治性患者,额外的新辅助治疗周期与较高的应答率无关。在未来的Ⅲ期试验中,患者将接受3个周期的阿帕替尼联合SOX的新辅助治疗。
虽然本研究有一定的局限性:单臂设计,不能排除选择偏倚,样本量不大,但是,最终结果显示了阿帕替尼联合SOX的有效性的安全性。一项大型、多中心、随机临床试验可能证实阿帕替尼联合SOX在局部进展期胃癌新辅助治疗中的优势。
参考文献
(上下滑动可查看)
1.BrayF,FerlayJ,SoerjomataramI,SiegelRL,TorreLA,:GLOBOCANesti;68(6):394-424.doi:10.3322/
2.PyoJH,LeeH,MinBH,:;111(2):240-249.doi:10.1038/
3.SongunI,PutterH,KranenbargEM,SasakoM,:15-;11(5):439-449.doi:10.1016/S1470-2045(10)70070-X
4.CunninghamD,AllumWH,StenningSP,etal;;355(1):11-20.doi:10.1056/NEJMoa055531
5.NCCNClinicalPracticeGuidelinesinOncology:;2015.
6.OkinesAFC,NormanAR,McCloudP,KangYK,CunninghamD,Meta-analysisoftheREAL-2andML17032trials:evaluatingcapecitabine-basedcombinationchemotherapyandinfused5-fluorouracil-basedcombinat;20(9):1529-1534.doi:10.1093/annonc/mdp047
7.YamadaY,HiguchiK,NishikawaK,;26(1):141-148.doi:10.1093/annonc/mdu472
8.WagnerAD,GrotheW,HaertingJ,KleberG,GrotheyA,:;24(18):2903-2909.doi:10.1200/
9.CunninghamD,OkinesAF,;362(9):858-859.doi:10.1056/NEJMc0911925
10.TianS,QuanH,XieC,f;102(7):1374-1380.doi:10.1111/
11.LiJ,QinS,XuJ,,double-blind,placebo-controlledphaseIIItrialofapatinibinpatientswithchemotherapy-refractoryadvancedo;34(13):1448-1454.doi:10.1200/
12.Jian-XianLin,eatmentforLocallyAdvancedGastricCancer:;4(7)::10.1001/
13.ZhengY,YangX,YanC,npathologicresponseinpatientswithlocallyadvancedgastricadenocarcinoma:asingle-arm,open-label,;130:12-19.doi:10.1016/
14.MartinRCII,JaquesDP,BrennanMF,:;194(5):568-577.doi:10.1016/S1072-7515(02)01116-X
15.WangSY,YehCN,LeeHL,;16(10):2738-2743.doi:10.1245/s1-0
16.NagataT,IchikawaD,KomatsuS,;104(6):592-597.doi:10.1002/
17.Al-BatranSE,HofheinzRD,PauligkC,,oxaliplatin,fluorouracil,andleucovorinversusepirubicin,cisplatin,andfluorouracilorcapecitabineinpatientswithresectablegastricorgastrooesophagealjunctionadenocarcinoma(FLOT4-AIO):resultsfromthephase2partofamulticentre,open-label,randomisedphase2/3;17:1697-1708.
18.WangX,ZhaoL,LiuHF,;114:1326-1333.
19.OkiE,EmiY,KusumotoT,(DS)asne;21:2340-2346.
20.ShrikhandeSV,BarretoSG,TaloleSD,;11:31.doi:10.1186/1477-7819-11-31
版权声明:本站所有作品(图文、音视频)均由用户自行上传分享,仅供网友学习交流,不声明或保证其内容的正确性,如发现本站有涉嫌抄袭侵权/违法违规的内容。请举报,一经查实,本站将立刻删除。