编者按

理论指引:GLP-1RA联合SGLT-2i机制互补,协同增效
01
协同降糖作用
GLP-1RA可以增加葡萄糖依赖性胰岛素分泌,抑制胰高血糖素分泌,增加肌肉组织葡萄糖摄取,减少肝糖原输出,增强肠促胰素效应,改善神经递质功能紊乱,作用涵盖糖尿病发病机制“八重奏”里的六重[1]。SGLT-2i主要通过抑制肾脏近端小管对葡萄糖的重吸收,降低肾糖阈、促进葡萄糖从尿液排泄,从而达到降低血液循环中葡萄糖水平的作用[2]。从作用机制来看,两类药物联用的机制互补,可以带来更优的降糖疗效(图1)。
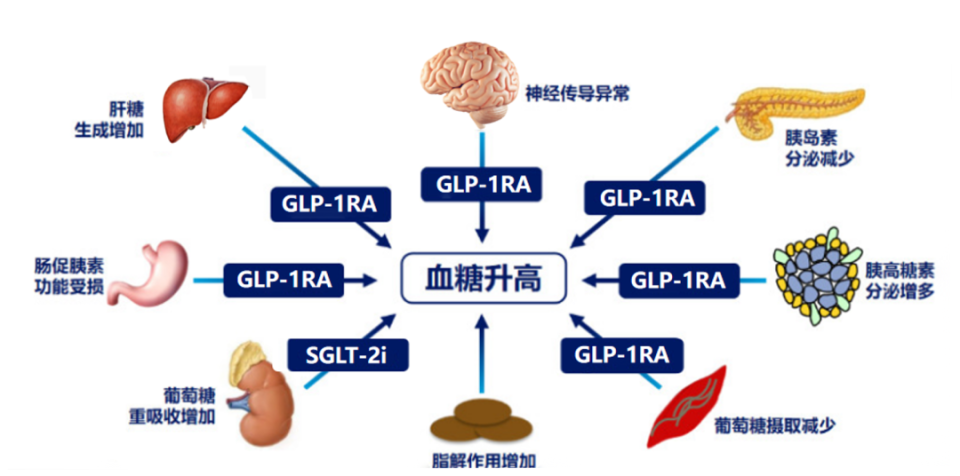
图1.GLP-1RA和SGLT-2i的降糖作用机制
注:GLP-1RA,胰高糖素样肽-1受体激动剂;SGLT-2i,钠-葡萄糖协同转运蛋白2抑制剂
02
心血管保护作用
GLP-1RA和SGLT-2i的心血管保护机制是互补的,且作用独立于降糖之外[3-4]。GLP-1RA可以通过多条作用途径抑制动脉粥样硬化的形成和进展,其中包括减少氧化型低密度脂蛋白形成,减少泡沫细胞形成,减少病变区域巨噬细胞浸润,减少内皮功能障碍,降低氧化应激水平等[5-7]。SGLT-2i的心血管获益主要与改善血流动力学、改善心肌能量供应相关[8-10](图2)。这两类药物心血管获益的作用机制不同,联合应用可能会产生更强的心脏保护作用[6]。
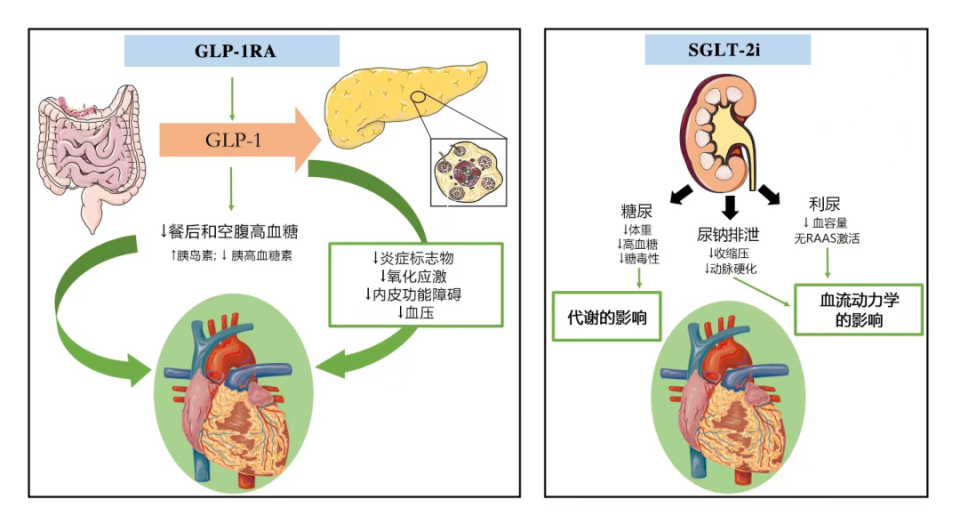
图2.GLP-1RA和SGLT-2i的心血管保护机制
注:GLP1-RA,胰高糖素样肽-1受体激动剂;GLP-1,胰高糖素样肽-1;SGLT-2i,钠-葡萄糖协同转运蛋白2抑制剂
03
肾脏保护作用
GLP-1RA的肾脏保护作用涉及的主要途径包括改善血糖控制,通过受体激活途径减少肾脏的炎症和纤维化[11](图3)。此外,GLP-1RA可以调节尿钠和利尿,维持肾脏中的钠稳态[11]。SGLT-2i除改善血糖控制外,还可以通过降低血压、改善肾脏血流动力学、减少尿钠重吸收、通过受体和非受体途径抑制肾脏炎症分子表达并促进促红细胞生成素产生等作用机制,发挥肾脏保护作用[12-13](图4)。从作用机制来看,GLP-1RA和SGLT-2i联合应用可协同改善肾脏炎症和纤维化。
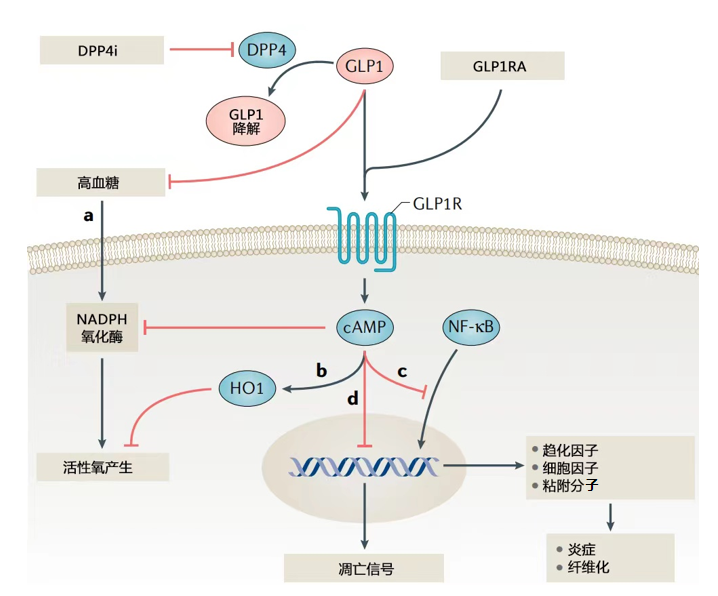
图3.肾脏细胞GLP-1与受体结合介导的信号通路
注:DPP4i,二肽基肽酶4抑制剂;DPP4,二肽基肽酶4;GLP1,胰高糖素样肽-1;GLP1R,胰高糖素样肽-1受体;GLP1RA,胰高糖素样肽-1受体激动剂;NADPH,还原性辅酶II;cAMP,环磷腺苷;HO1,血红素加氧酶1;NF-kB,核转录因子-kB
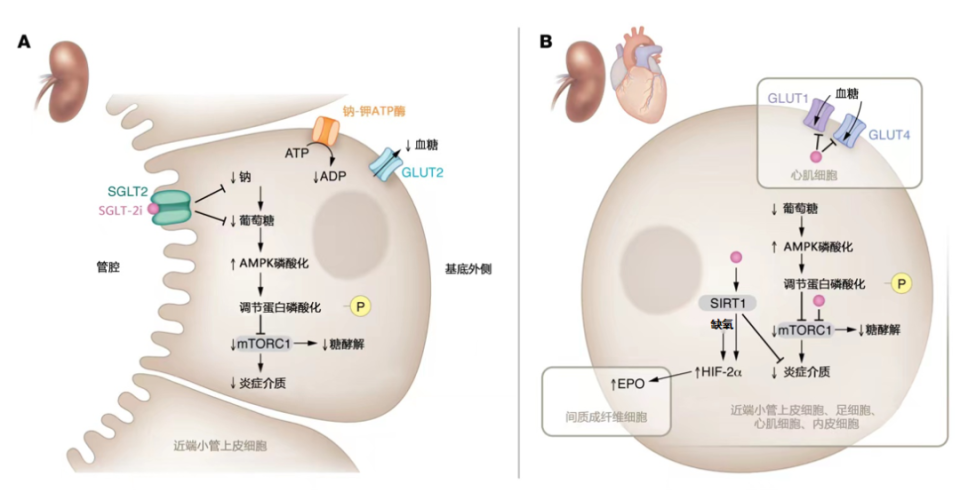
图4.SGLT-2i的肾脏保护作用
注:SGLT2,钠-葡萄糖协同转运蛋白2;SGLT-2i,钠-葡萄糖协同转运蛋白2抑制剂;ATP,三磷酸腺苷;ADP,二磷酸腺苷;AMPK,腺苷酸活化蛋白激酶;mTORC1,雷帕霉素复合物1;GLUT1,葡萄糖转运体1;GLUT2,葡萄糖转运体2;GLUT4,葡萄糖转运体4;SIRT1,沉默信息调节因子1;HIF-2α,缺氧诱导因子2α;EPO,促红细胞生成素
04
在肝脏的协同作用
除体重减轻带来的非酒精性脂肪性肝病(NAFLD)获益外,GLP-1RA可以通过调节胰岛素信号通路减少肝细胞内甘油三酯的储存,改善肝脏脂肪变性;激活肝细胞自噬机制,减轻内质网应激介导的细胞凋亡,减少肝细胞内脂肪酸的累积;激活法尼醇X受体抑制新生脂肪生成并改善肝脏炎症等[15](图5)。SGLT-2i在改善肝脏脂肪变性、降低血浆转氨酶水平和肝纤维化指标方面也有益处,考虑主要与体重减轻有关[16]。
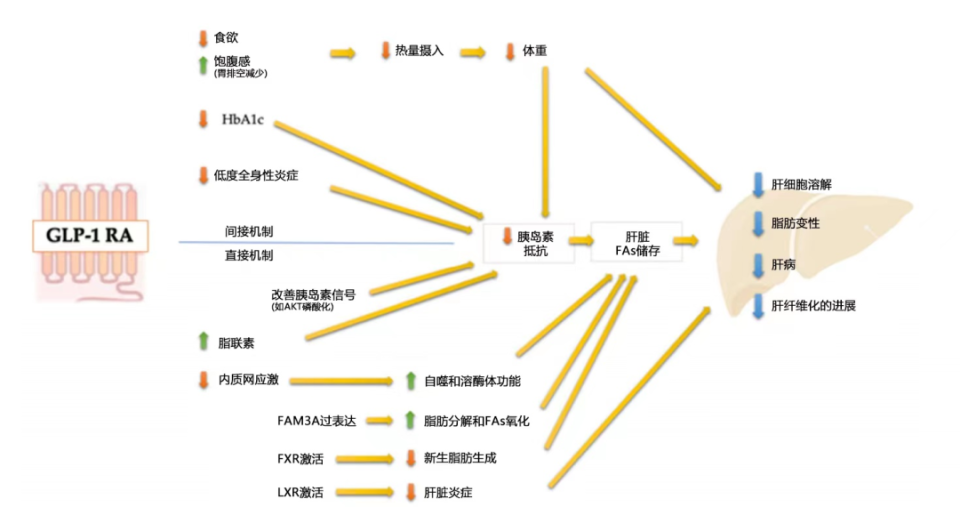
图5.GLP-1RA对肝脏糖脂代谢、炎症和纤维化的影响
注:GLP-1RA,胰高糖素样肽-1受体激动剂;HbA1c,糖化血红蛋白;FAs,脂肪酸;AKT,蛋白激酶B;FAM3A,细胞因子FAM3的家族成员之一;FXR,法尼醇X受体;LXR,肝脏X受体
实践真知:始于机制,践于临床,加倍获益
事莫明于有效,论莫定于有证。只有在充分的循证医学证据支持下,理论方可转化为实践,为糖尿病的综合管理找准方向。接下来就让我们一起回顾GLP-1RA和SGLT-2i联合治疗的临床证据。
01
优化血糖管理
AWARD10、DURATION8、SUSTAIN9等是GLP-1RA和SGLT-2i联用的大型RCT研究[17-20]。以SUSTAIN9为例,这是一项随机双盲、安慰剂对照研究,评估使用SGLT-2i联合或不联合二甲双胍/磺脲类(SU)药物治疗血糖控制不佳的2型糖尿病(T2DM)患者,加用司美格鲁肽周制剂联合治疗后的疗效及安全性。该研究共纳入302例T2DM患者,平均年龄57岁,基线平均BMI32kg/m2,平均糖化血红蛋白(HbA1c)8%。干预30周后,司美格鲁肽1.0mg联合SGLT-2i治疗组较对照组(安慰剂联合SGLT-2i)显著降低HbA1c水平(1.5%%)、改善7点自我监测血糖谱,并提高HbA1c<7%达标率(78.7%%)。安全性良好,联合治疗组严重或确证性低血糖发生率低[19]。
一项纳入8项RCT研究,共1895例T2DM患者的荟萃分析发现:与GLP-1RA或SGLT-2i单药治疗相比,联合治疗患者的HbA1c、空腹血糖、餐后2小时血糖等糖代谢指标降幅显著更大,且无重大安全性问题[21]。
02
强化心血管获益
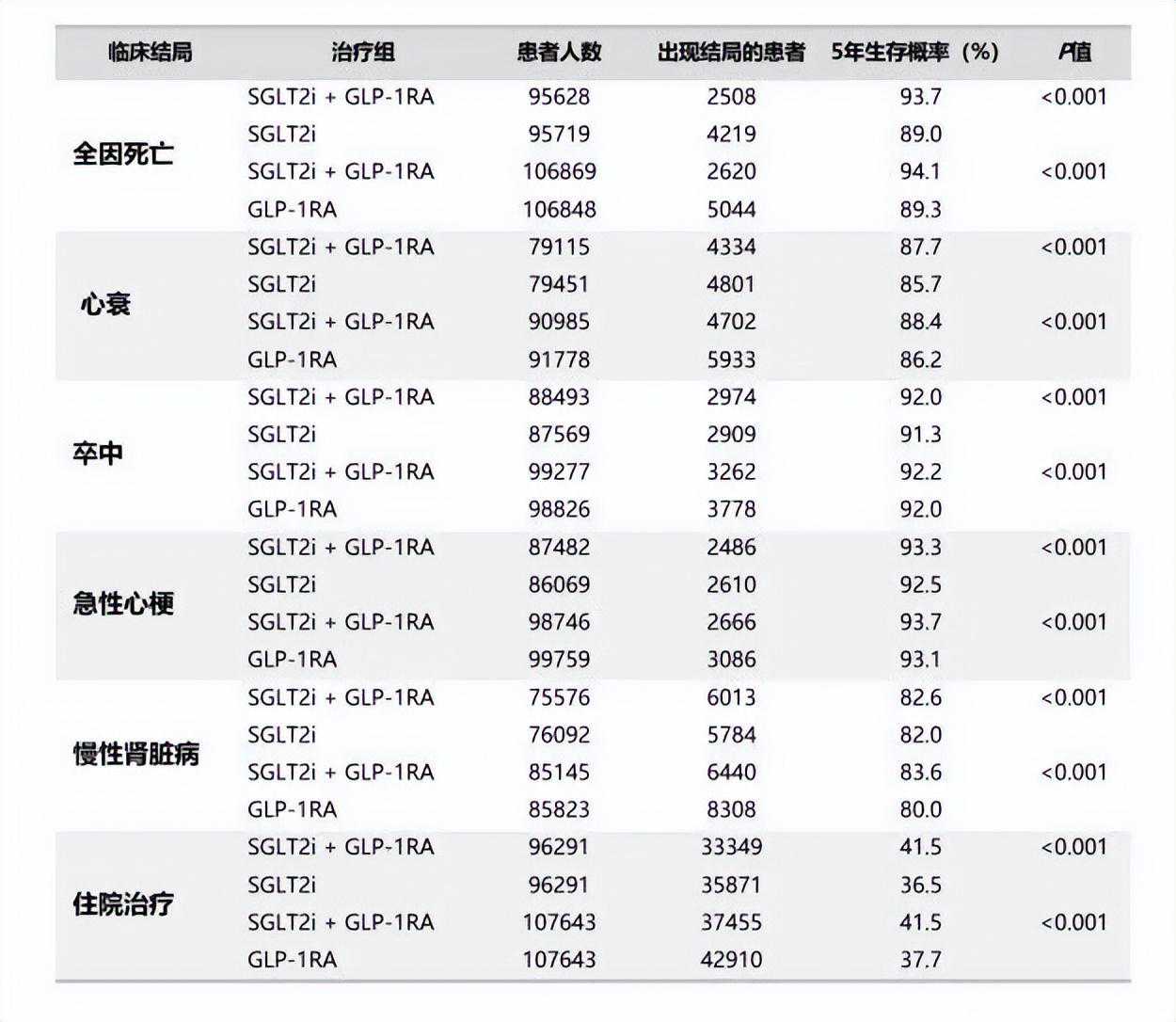
一项最近发表于Diabetes,ObesityandMetabolism杂志的真实世界研究,探讨了T2DM患者使用SGLT-2i、GLP-1RA及其联合治疗与患者5年全因死亡、住院和心血管/大血管病变风险的关系。该回顾性队列分析共分为四组,SGLT-2i治疗组14.4万人,GLP-1RA治疗组18.7万人,GLP-1RA联合SGLT-2i治疗组10.9万人和对照组(未用SGLT-2i/GLP-1RA)185万人。根据患者的年龄、性别、合并症情况和HbA1c水平,采用倾向性评分方式1:1匹配队列。结果显示,SGLT-2i治疗组、GLP-1RA治疗组以及SGLT-2i和GLP-1RA联合治疗组,较对照组均显著降低T2DM患者的5年全因死亡、心衰、卒中、急性心梗、慢性肾脏病和住院治疗风险。亚组分析显示,与SGLT-2i单药治疗或GLP-1RA单药治疗相比,联合治疗组的5年风险降低更加显著(表1)[22]。
表1.不同治疗组的事件结局发生率比较
2023EASD学术年会中也披露了一项GLP-1RA与SGLT-2i联用在心衰和主要心血管不良事件(MACE)方面获益的研究。该研究纳入2010至2021年间,在丹麦国家注册数据库中接受二联治疗的T2DM患者。使用纵向因果推理框架,假设所有患者均接受一种二联治疗5年,来确定接受不同二联治疗组合的T2DM患者的心衰、MACE和全因死亡估计风险。研究共纳入87201例患者,GLP-1RA联合SGLT-2i组14831人,GLP-1RA联合二肽基肽酶4抑制剂(DPP4i)/SU/噻唑烷二酮类药物(TZD)组20417人,SGLT-2i联合DPP4i/SU/TZD组22803人,DPP4i/SU/TZD二联疗法组29150人。结果显示,与DPP4i/SU/TZD二联疗法相比,接受GLP-1RA与SGLT-2i联合治疗的T2DM患者,5年心衰风险降低7%,MACE风险降低9%,全因死亡风险降低22%[23](图6)。
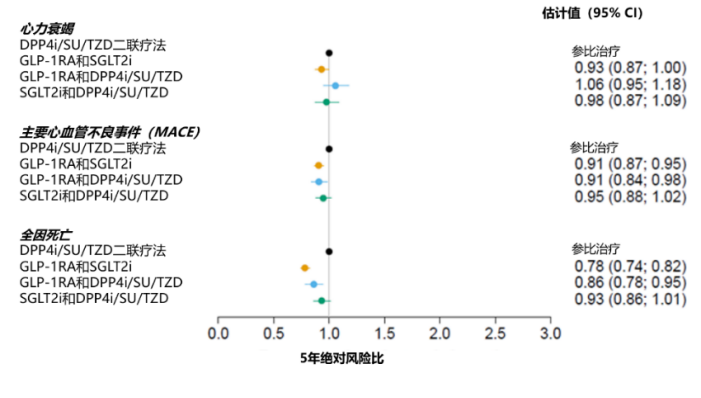
图6.不同二联疗法的心衰、MACE和全因死亡风险比较
注:DPP4i,二肽基肽酶4抑制剂;SU,磺脲类;TZD,噻唑烷二酮类;GLP-1RA,胰高糖素样肽-1受体激动剂;SGLT2i,钠-葡萄糖协同转运蛋白2抑制剂;CI,置信区间
上述研究结果提示:GLP-1RA和SGLT-2i联合治疗可以强化2型糖尿病患者的心血管获益。
03
展现肾脏保护作用
日本研究团队对GLP-1RA与SGLT-2i联用在肾脏方面的获益做了许多探索。一项在2023ADA学术年会上展示的研究,通过分析患者估算的肾小球滤过率(eGFR)变化轨迹,评估GLP-1RA与SGLT-2i联合治疗对慢性肾脏病(CKD)的影响。研究共纳入合并CKD3-4期的T2DM患者75例,平均年龄70岁,49%的患者伴大量蛋白尿。研究发现,在使用GLP-1RA治疗后,eGFR下降速度由16.7±19.8ml/min/1.73m2/年降至5.0±5.8ml/min/1.73m2/年,进一步加用SGLT-2i治疗后,eGFR下降速度进一步改善至每年下降2.7±3.8ml/min/1.73m2[24]。
另一项日本团队最新发表的回顾性研究,纳入547例T2DM患者。根据患者的年龄、性别、HbA1c、体重、血压、eGFR和药物使用情况等,采用倾向性评分方式1:1匹配了GLP-1RA与SGLT-2i联合治疗组和GLP-1RA单药治疗组患者各186例。结果显示:两组患者肾脏复合结局(蛋白尿进展和/或eGFR每年下降≥15%)的发生率无显著差异;然而,与单药治疗相比,接受GLP-1RA与SGLT-2i联合治疗的患者eGFR的年下降幅度明显减小(-1.1±5.0ml/min/1.73m2vs.-2.8±5.1ml/min/1.73m2),尿微量白蛋白比肌酐(UACR)下降幅度更大(-0.08±0.61±0.52)[25]。
利用与上文心血管结局研究中同样的丹麦人群,研究团队探索了GLP-1RA与SGLT-2i联用在肾脏预后方面的优势。研究方法一致,结果显示,与DPP4i/SU/TZD二联疗法相比,接受GLP-1RA与SGLT-2i联合治疗的T2DM患者,5年慢性肾脏病疾病风险相似,但终末期肾脏病发生风险显著降低88%,eGFR降低50%风险显著降低48%[26](图7)。
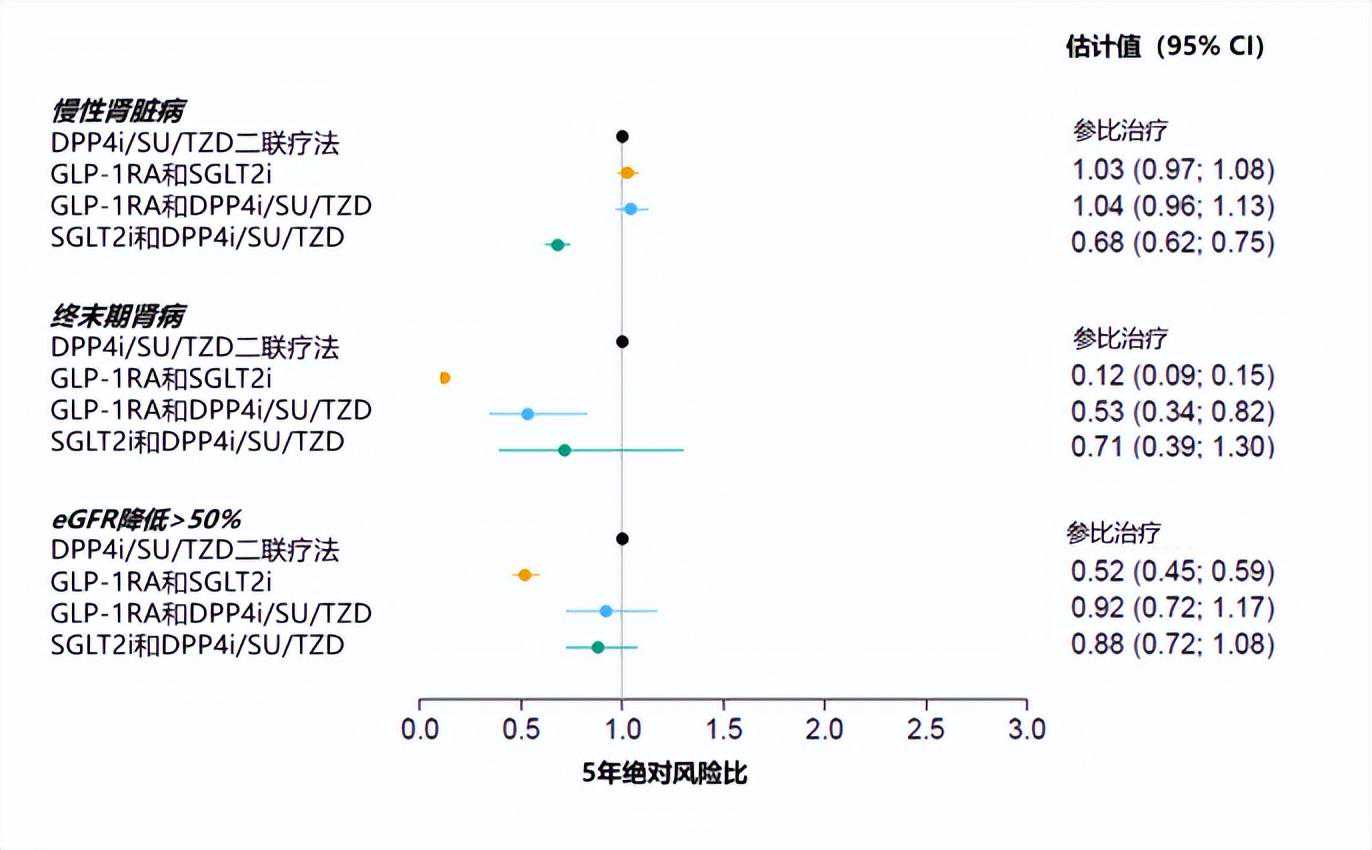
图7.不同二联疗法的肾脏结局比较
注:DPP4i,二肽基肽酶4抑制剂;SU,磺脲类;TZD,噻唑烷二酮类;GLP-1RA,胰高糖素样肽-1受体激动剂;SGLT2i,钠-葡萄糖协同转运蛋白2抑制剂;eGFR,估算的肾小球滤过率;CI,置信区间
上述研究结果提示:GLP-1RA和SGLT-2i联合治疗可以改善2型糖尿病患者的肾功能减退和远期肾脏结局。
04
助力肝脏获益
一项旨在阐明SGLT-2i作为对于已经使用肠促胰素治疗的合并NAFLD的T2DM患者二线治疗有效性的观察性研究,24例患者在肠促胰素(11例使用GLP-1RA、13例使用DPP4i)治疗的基础上联合使用SGLT-2i,发现谷丙转氨酶水平(从62到38IU/L)和纤维化-4(FIB-4)指数(从1.75到1.39)显著降低[27]。另一项回顾性研究,纳入6例接受SGLT-2i长期治疗的合并NAFLD的T2DM患者,在治疗前、治疗24周、3年和5年时均进行肝活检检查。在5年时,50%的患者组织学改善(定义为与治疗前相比,NAFLD活动性评分降低1分或更多,而纤维化未恶化),脂肪变性、小叶炎症和纤维化评分分别降低67%、33%和33%。其中有2例患者在3年后接受了GLP-1RA的额外治疗,这2例患者在第5年时的脂肪变性、气球样变和纤维化分期均未恶化[28]。
目前尚没有大样本的关于GLP-1RA和SGLT-2i联合治疗改善合并NAFLD/非酒精性脂肪型肝炎(NASH)的T2DM患者肝脏结局的研究证据,但上述小样本的研究结果提示:较单药治疗而言,GLP-1RA和SGLT-2i联合治疗可以进一步改善患者的肝酶水平及肝脏组织学表现。
结语
药物的联合治疗是T2DM管理的重要模式,GLP-1RA和SGLT-2i是近年来在临床中广泛应用的新型降糖药物。从作用机制和临床证据来看,GLP-1RA与SGLT-2i的联合治疗与更优的血糖控制、更强的心血管获益、更好的肾脏保护,以及NAFLD的生化和/或组织学特征改善密切相关,提示GLP-1RA与SGLT-2i的联合治疗是增加T2DM患者临床获益的治疗选择。相信随着越来越多研究数据的公布,GLP-1RA与SGLT-2i联合治疗方案的临床获益证据会逐渐完善,也期待未来更多联合治疗的优势被挖掘。
专家简介
彭永德教授
医学博士、主任医师、博士生导师

上海交通大学医学院附属第一人民医院内分泌代谢科学科主任、甲状腺疾病诊疗中心主任、骨质疏松症联合诊疗中心主任,长三角糖尿病联盟主席,中华医学会内分泌学分会副主任委员基础学组组长、上海市医学会内分泌分会前任主任委员、中国老年保健医学研究会老年内分泌与代谢病分会副主任委员、中国医师协会内分泌代谢科医师分会常委。《上海医学》及《CurrentMedicine》副主编,《JClinocrinolMetab》、《中华内分泌代谢杂志》、《中华糖尿病杂志》、《中国糖尿病杂志》、《中华器官移植杂志》及《中国临床保健杂志》杂志编委,《Metabolism》、《Microbiome》、《JDiabetesComplications》、《ChinaJMed》等杂志特邀审稿人。已发表论文450篇(SCI120篇,包括Science、PNAS、JCEM等),主编《系统内分泌学》等教材专著6部,参编教材专著12部。2004年获教育部科技进步一等奖、2012年获上海市医学科技二等奖,2014获中华医学科技三等奖、华夏医学科技三等奖。2014年及2018分别获上海市第一人民医院院长奖(医疗)及院长奖(科研),2016年获上海交通大学优秀教师,2020年获中国十大医学影响力专家,2021获上海市医务工匠,2023年获国之名医·卓越建树奖。

参考文献
(上下滑动可查看)
1.DeFronzoRA,;36Suppl2(Suppl2):S127-38.
2.GalloLA,,2015,12(2):78-89.
3.CastellanaM,;9(1):19351.
4.LamCSP,;145(8):565–74.
5.;33(2):165–74.
6.;19(10):1353–62.
7.NauckMA,;46:101-102.
8.Díaz-TrastoyO,;42(2):e1–12.
9.BertocciniL,;1307:193–212.
10.LoCWH,;7:e04.
11.AlicicRZ,;17(4):227-244.
12.卫芳祎,等.中华糖尿病杂志,2021,13(12):1182-1186.
13.;133(5):e167700.
14.DongY,;41(3):284-295.
15.NevolaR,;24(2):1703.
16.GastaldelliA,;22(3):393–403.
17.Ludvik,,6(5),370–381.
18.Jabbour,,43(10),2528–2536.
19.Zinman,,7(5),356–367.
20.BlondeL,;22(6):929-937.
21.LiC,;13:838277.
22.RileyDR,;25(10):2897-2909.
23.ZareiniB,;72(Supplement_1):200-LB.
24.KOJIKASHIMA,;72(Supplement_1):422-P
25.KobayashiK,;12(4):e0292.
26.ZareiniB,;72(Supplement_1):201-LB.
27.OhkiT,;36.
28.AkutaN,;6(9):2286-2297.
声明:本文仅供医疗卫生专业人士了解最新医药资讯参考使用,不代表本平台观点。该等信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议,如果该信息被用于资讯以外的目的,本站及作者不承担相关责任。
版权声明:本站所有作品(图文、音视频)均由用户自行上传分享,仅供网友学习交流,不声明或保证其内容的正确性,如发现本站有涉嫌抄袭侵权/违法违规的内容。请举报,一经查实,本站将立刻删除。